C'è molta confusione in merito al legame tra salute e funghi, intesi come i vari miceti che vengono in contatto con l'uomo e non (solo) come porcini o altre specie, ma anche come organismi uni o multicellulari che possono annidarsi nel nostro intestino o in altre parti, solitamente in maniera innocua (micobiota). Alcuni funghi hanno anche proprietà medicinali, come lo shitake e il reishi.
 |
| https://www.facebook.com/164064580300043/photos/a.535113209861843/620567674649729/ |
Per fare un po' di chiarezza è uscita una posizione ufficiale dell'EAACI, la società europea di allergologia, sul legame tra funghi e reazioni avverse.
I funghi sono organismi eucarioti, eterotrofi, principalmente aerobi, che possiedono chitina nelle loro pareti cellulari ed ergosterolo nelle membrane. Le forme vegetative unicellulari possono essere chiamate lieviti.
Alcuni funghi hanno dimorfismo, ossia possono passare ad un'altra forma che può non essere innocua ma patogena. Per esempio la Candida è normalmente unicellulare, ma può passare alla forma invasiva di ifa, che è formata da più cellule messe insieme (passaggio a una forma multicellulare). Diverse specie stanno destando preoccupazione per la salute pubblica.
Il dimorfismo permette ai funghi di svilupparsi sia nell'ambiente (libero e come saprotrofi) che nell'ospite (parassita).
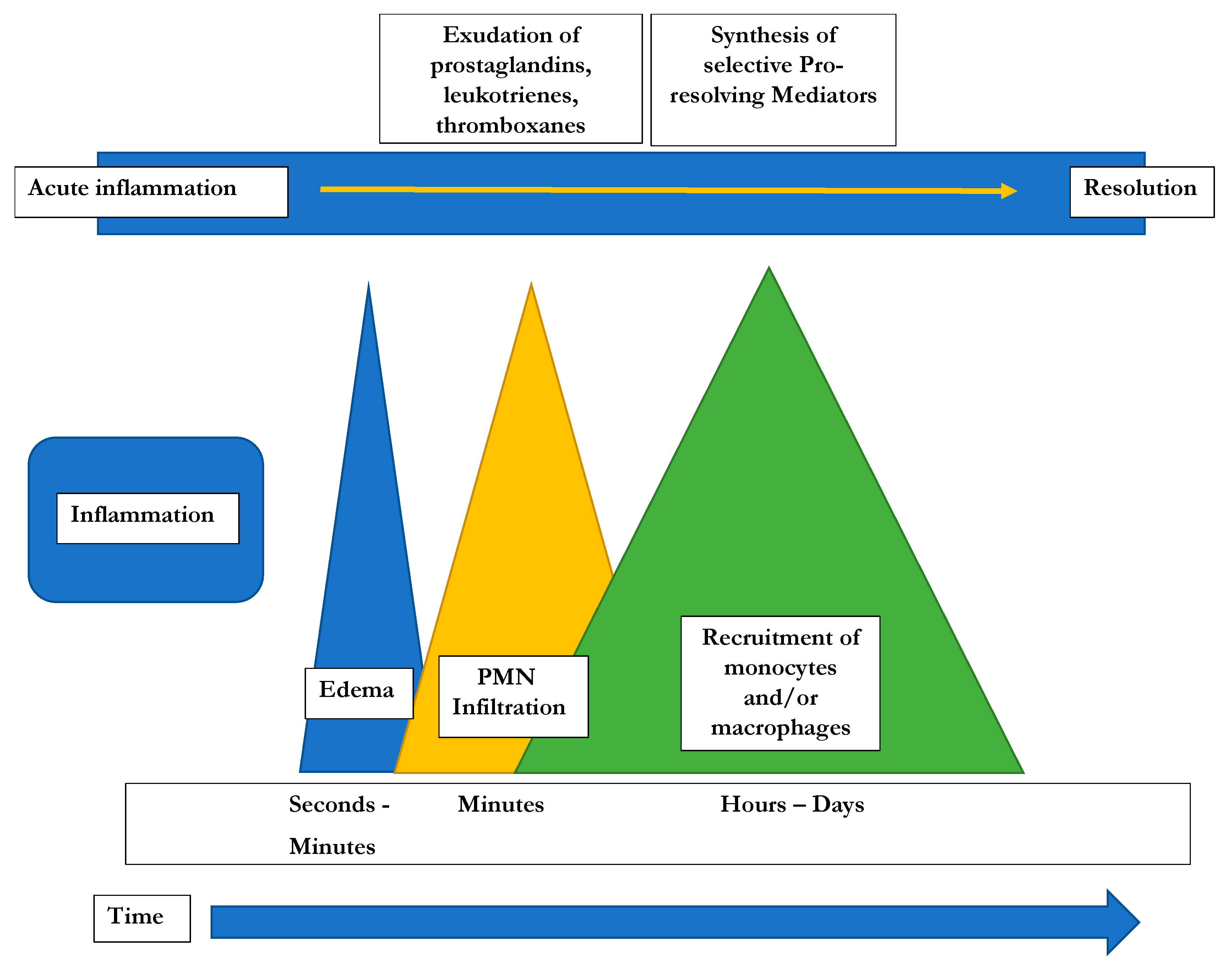
"La transizione a entrambe le forme può essere associata ad un aumento della patogenicità. Come altre forme fungine, i lieviti possono causare reazioni di ipersensibilità, infezioni o entrambe. Possono verificarsi infezioni gravi in ospiti immunocompetenti; al contrario, i lieviti possono persistere all'interno dell'ospite, manifestandosi come infezioni opportunistiche alla soppressione immunitaria o ritornando nell'ambiente come saprotrofi dopo la morte dell'ospite. Esempi di lieviti di importanza medica nell'uomo sono mostrati in Tabella" (e come si può notare sono comunque normalmente presenti nell'organismo).

Sono presenti naturalmente nell'intestino sano miceti che rappresentano il micobiota come Saccharomyces, Malassezia, Candida e Cyberlindnera, tuttavia non si è esattamente definito un micobiota sano/fisiologico.
Il documento ci informa che i funghi sono una causa importante di malattie nell'uomo, incluso ipersensibilità di tipo I (le classiche allergie IgE mediate), ma anche di tipo 3 e tipo 4 (rispettivamente mediate da IgG e cellule T). Queste ipersensibilità stanno emergendo grazie alle nuove tecnologie.
Ma perché alcune persone manifestano malattia e altre no?
"Sebbene i funghi stimolino i PAMP (ligandi per i recettori di riconoscimento del modello immunitario innato (PRR) dell'ospite), la maggior parte delle interazioni tra i funghi e l'ospite umano non provocano la malattia. Invece, una malattia fungina di solito si manifesta in ospiti suscettibili. L'infezione è spesso associata a deficienza immunitaria, mentre l'ipersensibilità di tipo I si verifica principalmente nei pazienti atopici (allergici). A seconda della capacità di un dato fungo di crescere alla temperatura corporea umana (funghi termotolleranti) o meno (funghi mesofili), la minaccia patogena posta all'ospite umano è sia infettiva che allergica o solo allergica. Esempi tipici di funghi termotolleranti importanti dal punto di vista medico sono Aspergillus fumigatus e Candida albicans, mentre Alternaria alternata e Cladosporium herbarum gradiscono temperature intermedie".
I funghi possono creare danno anche rilasciando micotossine, sostanze prodotte dal fungo per facilitare la loro alimentazione. Le micotossine possono essere dannose se ingerite col cibo contaminato conservato, mentre non lo sono se inalate per via aerea.
Gli antigeni dei funghi sono proteine che innescano le reazioni immunitarie IgE e IgG. Esistono alcuni esempi di crossreattività di sostanze presenti tra regni diversi, come la chitina, presente nei funghi, nei crostacei, negli aracnidi e negli insetti, e la Malassezia, che ha proteine simili a quelle della cute.
I funghi possono rilasciare anche VOC (composti organici volatili) che possono indurre affaticamento, letargia, mal di testa, irritazione delle mucose oculari e delle vie aeree superiori e respiro sibilante, e in generale infiammazione, tuttavia la loro importanza per la salute umana è ancora controversa.
L'esposizione ai funghi avviene mediante molteplici vie: inalazione, ingestione, contatto ecc.
"Le interazioni fungo-ospite umano includono una combinazione di ipersensibilità, tossicità e infezioni opportunistiche. L'esposizione interna ed esterna ai funghi è ubiquitaria ed è alterata dai cambiamenti climatici. Facendo riferimento alla classificazione di Gell e Coombs, le ipersensibilità ai funghi possono essere di tipo I (IgE), III (IgG) e IV (cellule T) con i meccanismi immunitari relativi, ad esempio immunità innata e adattativa di tipo 2".
Sia le IgG che le IgE possono essere monitorate nel siero per verificare le patologie allergiche.
La rinosinusite allergica legata ai funghi è associata ad Aspergillus (soprattutto), Candida e Alternaria in oltre la metà dei casi, ma solo in determinate condizioni climatiche (caldo e umidità) si ha manifestazione.
Anche l'asma fungina è associata a queste tre specie, così come alle muffe. Esiste inoltre una forma occupazionale che riguarda i panificatori, associata al S. cerevisiae (lievito di birra) o agli enzimi. L'asma in generale può essere influenzata dal micobiota, in particolare da Candida e Rhodotorula presenti nell'intestino. Altre complicazioni possono essere polmonite da ipersensibilità e micosi polmonare allergica.
Per quanto riguarda le malattie cutanee, orticaria colinergica e soprattutto dermatite atopica, legata alla Malassezia. Questo fungo rilascia proteine che creano mimetismo molecolare, inducendo un processo autoimmune. È anche responsabile della forfora e della dermatite atopica (assieme a S. aureus).
Malassezia e Candida appaiono implicate anche in malattie intestinali (IBD) come Crohn e colite ulcerosa, influenzando sia genesi che progressione e gravità di queste patologie.
In altri articoli ho trattato il rapporto tra Candida e salute, in particolare il legame con l'insufficienza cardiaca.
Esiste invece un'intolleranza al lievito di birra? Secondo una recente pubblicazione gli epitopi antigenici vengono alterati e inattivati dal calore, ma alcune persone potrebbero avere sensibilità. Sono tuttavia necessari ulteriori ricerche.
È noto che dieta corretta, alcuni fitoterapici e uno stile di vita corretto possono contrastare le crescite fungine patologiche nell'intestino e quindi ridurre i rischi delle malattie collegate. Viceversa diversi fattori ambientali (stress, alcol, sedentarietà, fumo, cicli di antibiotici) aumentano il rischio di infezione fungina (o meglio sovracrescita di funghi normalmente presenti in quantità non dannose).
Muffe
Per le persone sensibili alle muffe, raccomando l'articolo di Chris Kresser. L'esposizione porta a infiammazione e alterazione del sistema immunitario. Anche la neuroinfiammazione è comune e può favorire la nebbia cerebrale, la depressione e la disfunzione cognitiva. Inoltre le micotossine bloccano il sistema immunitario e possono persino riattivare infezioni latenti. L'esposizione cronica alla muffa compromette anche la risposta immunitaria agli agenti patogeni, aumentando il rischio di infezioni opportunistiche.
Le muffe possono avere inoltre effetto negativo sul microbiota ed esaurire le riserve cellulari di glutatione, prezioso antiossidante.
Le muffe casalinghe (indoor) destano ugualmente preoccupazione, grazie al rilascio di micotossine.
Micotossine
Le micotossine si possono accumulare nella catena alimentare se non vengono seguite le corrette tecniche di conservazione; una categoria di cibi a rischio è quella dei latticini. Anche i cereali sono a rischio, e questo penso possa almeno parzialmente spiegare perché alcune persone stanno meglio se li evitano. Gli autori dello studio avvisano comunque che i vantaggi derivanti dal consumo sono superiori ai rischi legati ai contaminanti, in quanto sono alimenti ricchi di nutrienti, in particolare se integrali, e la principale fonte di carboidrati nelle nostre diete. L'uso dell'integrale inoltre favorisce una flora che possa decontaminare dalle tossine.
È stata osservata anche una possibile correlazione delle micotossine alimentari con malattie neurodegenerative, in collaborazione con l'eccesso alimentare e l'LPS batterico.
Per approfondimenti potete consultare il mio articolo sul legame tra tossicità e dieta
I funghi come medicina
Come accennato all'inizio, si ritiene che alcuni funghi possano avere proprietà benefiche e potenzialmente terapeutiche. Tra di esse si elencano: antiossidanti, antinfiammatorie, antitumorali (sia in prevenzione che in terapia), antidiabetiche, antiCOVID19.
Alcuni funghi medicinali hanno proprietà positive nei confronti della funzione cardiaca e in particolare nell'ipertensione, ma la loro azione sembra essere utile solo nelle prime fasi della condizione.
Tra i composti attivi troviamo ergosterolo, lovastatina, cordicepina, tocoferoli, chitosano, ergotioneina, acido γ-aminobutirrico, quercetina ed eritadenina.
La presenza di composti potenzialmente tossici ne limita l'impiego.
Ganoderma lucidum (reishi) può aumentare Akkermansia, un batterio benefico per il metabolismo. Gli sono inoltre riconosciute "numerose proprietà farmacologiche, quali antitumorali, ipoglicemizzanti, immunomodulanti, antipertensive, citotossiche, antidiabetiche, antiossidanti, anti-iperlipidemiche, antimutagene, antinvecchiamento, antimicrobiche ed epatoprotettive".
Shiitake (Lentinula edodes) ha proprietà metaboliche sull'uomo (ipotensive, ipoglicemizzanti e ipolipidemizzanti) e immunomodulanti e antitumorali (solo in vitro per ora). Ha inoltre proprietà prebiotiche, supportando il recupero dopo gli antibiotici assieme ai probiotici, o in generale agendo sulla flora disbiotica. Alcuni studi del bravo Armando D'Orta mostrano che il suo derivato AHCC può migliorare, grazie alle proprietà immunomodulanti, la risposta alla chemioterapia, in particolare ridurre gli effetti collaterali e migliorare la qualità della vita.
 |
https://mushroommarauder.com/products/coffee-makes-me-shiitake-mug
|
Anche la Grifola frondosa (maitake) ha proprietà metaboliche (colesterolo e glicemia) e antitumorali, modulando il sistema immunitario grazie ai β-glucani.
In generale gli studi oggi hanno bisogno di numeri più grandi perché effettuati su campioni ritenuti troppo piccoli. Vanno inoltre migliorate e standardizzate le produzioni di supplementi a base di funghi medicinali per assicurare purezza e concentrazioni idonee.
Alcuni studi mostrano un potenziale antipertensivo di alcuni funghi medicinali. L'effetto è legato a diversi meccanismi
La colangite sclerosante primitiva (PSC) è una malattia epatica cronica, fibroinfiammatoria, colestatica, di eziopatogenesi sconosciuta, spesso associata a malattie infiammatorie intestinali come la rettocolite ulcerosa. Colpisce anche i bambini.
Le persone colpite sono affette da disbiosi che riguarda sia i batteri che i funghi intestinali. In particolare chi ha entrambe le malattie ha aumento di saccaromiceti, mentre chi ha solo rettocolite ha eccessi di candida. In entrambi i casi aumentano i batteri infiammatori come Klebsiella e si riducono quelli antinfiammatori come Akkermansia, Bacteroides, Parabacteroides e Oscillospira. Queste alterazioni determinano un'alterazione degli acidi biliari rendendoli infiammatori.
In conclusione "l'alterazione del micro/micobiota ha un ruolo nella patogenesi della PSC-UC, influenzando la produzione di molecole intestinali cruciali (ad esempio, gli acidi biliari). Quindi, gli interventi sul contenuto microbico e fungino dell’intestino potrebbero avere un ruolo protettivo o terapeutico nella PSC".