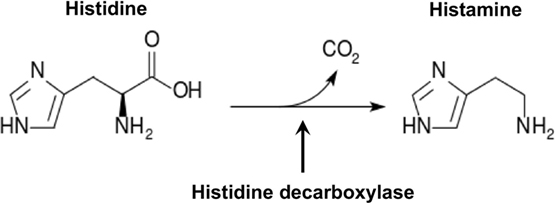
L'istamina è una delle amine biogene derivate dalla decarbossilazione (perdita di un gruppo carbossilico -COOH) degli aminoacidi, così come triptamina, catecolamine, serotonina ecc. In particolare l'istamina deriva dall'aminoacido istidina.
Agisce così su diversi tipi di recettori (dovrebbero essere 4, se nel mentre non ne scoprono altri) e la loro manipolazione può avvenire con diversi tipi di farmaci specifici, a seconda dell'effetto ricercato.
 |
| https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8469513/ |
L'istamina ha diverse funzioni nel corpo, tra cui stimolare la secrezione acida gastrica, l'infiammazione, la contrazione delle cellule muscolari lisce, la vasodilatazione e la produzione di citochine, modulazione di appetito e sonno. Immagazzinata in granuli nei basofili e nei mastociti, media alcune funzioni immunitarie, come l'allergia.
Funziona da neurotrasmettitore in alcuni tipi di sinapsi, i collegamenti tra neuroni.
La sintesi di istamina tramite decarbossilazione può avvenire al bisogno (tramite l'enzima decarbossilasi) o in modo naturale per "invecchiamento", come capita nei cibi non freschi ad opera degli enzimi batterici.
Circa 60 anni fa si ebbero i primi casi della cosiddetta sindrome sgombroide, dovuta all'ingestione di pesce non fresco, con sintomi simil-allergici.
La condizione è ora nota come intossicazione da istamina, intolleranza all'istamina, sensibilità all'istamina, istaminosi enterica o avvelenamento da istamina. Alcuni specialisti la chiamano anche "reazione avversa all'ingestione di istamina". La condizione può anche essere associata a una carenza enzimatica. L'incapacità di alcuni individui di metabolizzare l'istamina nell'intestino, con conseguente sensibilità a livelli di istamina normali o addirittura bassi nel cibo, provoca gli stessi problemi.
 |
| https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7463562/ |
In questo caso l'istamina riesce a raggiungere il sangue dall'intestino e provoca i suoi effetti. L'intolleranza all'istamina nasce infatti principalmente nell'intestino e può verificarsi quando si introduce istamina con la dieta, quando si hanno certi batteri che la producono e quando non si hanno livelli sufficienti di enzima che la degrada (diamminossidasi, DAO).
L'istamina viene infatti metabolizzata (degradata e quindi neutralizzata) da 2 enzimi, DAO e, in maniera inferiore, HMNT (che agisce all'interno delle cellule). Il primo ha necessità di rame; la carenza del metallo può così peggiorare la situazione, così come quella di vitamina C e B6.
Farmaci come antibiotici, antidepressivi, antiacidi, antiaritmici, antipertensivi, miorilassanti, narcotici, anestetici locali interferiscono con DAO. Gli antinfiammatori non steroidei (aspirina, ibuprofene ecc.) interferiscono col metabolismo dell'istamina riducendone la clearance.
Dal punto di vista farmacologico si può ricorrere ad antistaminici e cortisonici, oltre a eliminare i farmaci che possono esacerbare i sintomi, il tutto in accordo col medico.
I sintomi di un eccesso di istamina possono essere gastrointestinali aspecifici (compreso l'intestino irritabile che può essere concausato dall'istamina) o più specifici (vomito e diarrea, gonfiore, flatulenza, stitichezza, nausea), cutanei (rossore, eczema, prurito, ritenzione idrica, gonfiore), cardiaci (tachicardia, ipotensione, collasso), respiratori (rinorrea, congestione nasale, starnuti), neurologici (emicrania e vertigini).
La condizione può peggiorare nel periodo premestruale ed è associata a ciclo doloroso, mentre in gravidanza i livelli di DAO crescono enormemente grazie alla placenta.
La diagnosi può essere fatta con un'ingestione di istamina e osservazione dei sintomi, dopo dieta di esclusione, misurazione dell'attività di DAO e dell'istamina fecale o sierica o dei metaboliti urinari, prick test, ma in realtà l'intolleranza all'istamina per qualcuno non è un'entità nosologica definita.
La dieta a basso contenuto di istamina e la supplementazione con l'enzima possono ridurre i sintomi.
Dieta
I cibi che contengono o favoriscono il rilascio di istamina sono abbastanza definiti.
Quelli con maggiori quantità sono appunto quelli non freschi, soggetti a stagionatura o altri processi tecnologici (fermentazione).
Questo accade perché la decarbossilazione dell'istidina presente nel cibo che dà luogo all'istamina è provocata dai batteri oppure avviene naturalmente con il tempo senza necessità di enzimi.
Anche gli alimenti con glutine, a causa della lievitazione e del fatto che vengono consumati con pomodoro, possono creare problemi e ridurli può indirettamente migliorare i sintomi.
I sintomi intestinali sono correlati con l'istamina perché i mastociti, stimolati dal cibo infiammatorio, rilasciano la molecola, che regola il dolore e la sensibilità viscerale. Le vie sono stimolate dai cibi ricchi in istamina (alcolici come vino e birra, formaggi stagionati, alimenti in scatola) insieme a quelli che interagiscono con le IgG (e che portano a degranulazione dei mastociti).
Gli alimenti che devono essere evitati di solito sono formaggi a pasta dura e semidura, pesce azzurro e crostacei in qualsiasi forma, oltre a prodotti a base di carne fermentata cruda, verdure in salamoia, prodotti a base di soia fermentata, vino e birra, uova di gallina (soprattutto il bianco), cioccolato e funghi, ketchup e aceto. Carne e pesce possono essere consumati solo se freschi. Inoltre, dovrebbero essere evitate le verdure e la frutta che stimolano il rilascio di istamina endogena come spinaci, pomodori, agrumi, fragole, melanzane, avocado, papaya, banane, kiwi, ananas e prugne, arachidi.
Gli alcolici, gli energy drink, tè (verde e nero) e matè possono interferire con DAO e HMNT.
La fibra ha una certa importanza nel modulare i mastociti che rilasciano l'istamina endogena e così le malattie correlate (allergie, dermatite atopica, colite ulcerosa e Crohn).
Microbiota e probiotici
Il microbiota, com'è noto, ha forti influenze sulla salute e l'alimentazione è uno dei suoi maggiori modulatori. Il microbiota è un'importante fonte di amine che funzionano da neurotrasmettitori, influenzando tanti aspetti a partire dall'umore e può determinare anche un'"autointossicazione" per eccesso di istamina.
Alcuni batteri hanno capacità di degradare l'istamina, altri di produrla.
Le persone con intolleranza all'istamina sembrano avere più proteobatteri e meno bifidi. Sono inoltre presenti infiammazione e permeabilità intestinale, con riduzione dell'enzima DAO portando a un possibile circolo vizioso. Escherichia e Salmonella possono favorire il rilascio di istamina. In generale i lattobacilli possono produrre istamina e acido D-lattico, creando problemi. H. pylori, il batterio responsabile del tumore allo stomaco, induce il rilascio di istamina.
La candida può rilasciare istamina (e cortisolo) ed è così correlata con la sindrome dell'intestino irritabile.
Molte sostanze hanno effetto negativo sul microbiota e in questo modo possono facilitare l'insorgenza di intolleranza all'istamina. Tra di esse, molti farmaci (antibiotici ovviamente, antiacidi ecc.), metalli pesanti (mercurio, arsenico), pesticidi (che in alcuni casi si ritengono sicuri perché non colpiscono vie metaboliche dei mammiferi, ma quelle microbiche sì!), dolcificanti artificiali, il triclosan (usato nei saponi antibatterici), la nicotina (tabacco). Il danno avviene mediante alterazione dei metaboliti batterici e biliari, soprattutto SCFA, interferendo su umore, rischio cardiovascolare (TMAO), mediante perdita di specie batteriche utili (aumento del rischio di malattie intestinali) e mediante alterazione del bilancio energetico, favorendo l'aumento di peso. Per ripristinare il microbiota, ovviamente sono necessari dieta, probiotici e assenza, per quanto possibile, dei fattori negativi.
In uno studio un probiotico misto ha ridotto l'orticaria cronica in un gruppo di bambini, migliorando l'effetto degli antistaminici.
L'inulina, stimolando i bifidi, può migliorare il quadro dell'intolleranza all'istamina.
Integrazione con DAO
L'enzima DAO (diamminoossidasi) che degrada l'istamina può essere usato come supplemento in persone carenti. Questo integratore riduce l'istamina e i problemi collegati, come emicrania, vertigini, palpitazioni, sintomi gastrointestinali; riduce inoltre la durata dell'emicrania in persone con episodi non frequenti. Questo vale anche per l'orticaria cronica.
Altri integratori e fattori da considerare
Altri supplementi utilizzabili sono vitamina C, quercetina, bromelina, ortica, NAC (che però può anche inibire DAO). Altri flavonoidi come fisetina, kampferolo, rutina e luteolina e la berberina inibiscono il rilascio di istamina dai mastociti. Alcuni cibi potrebbero essere stabilizzatori dei mastociti.
Tra le spezie il basilico sacro (tulsi), menta piperita, timo, zenzero, curcuma, cumino nero, ortica.
L'alterazione dei mastociti può anche derivare dalla presenza di metalli pesanti, disbiosi o infezioni di batteri, virus, parassiti, vermi o funghi (candida), carenza di zinco e/o magnesio.
La vitamina D può essere utile nell'orticaria spontanea cronica, senza effetti collaterali.
Anche altri elementi, allergizzanti o meno, possono concorrere al rilascio di istamina in persone predisposte. Composti volatili (vernici, idrocarburi), muffe e altre biotossine, lectine (elementi di vegetali di patate, pomodori, legumi, cereali), infezioni latenti, ormoni come leptina, bradichinina e grelina, stress (il CRH attiva i mastociti), fluoro.
Aggiornamento 4/6/2022
Da cosa dipendono i dolori legati all'intestino irritabile dopo il pasto?
"Il cibo evoca e amplifica l'ipersensibilità viscerale attraverso percorsi dipendenti dai mastociti (1) e indipendenti dai mastociti (2). L'ingestione di cibi ricchi di carboidrati fermentabili (FODMAP e altri zuccheri scarsamente assorbiti) porta alla fermentazione batterica prevalentemente nel colon, producendo gas e metaboliti osmoticamente attivi che possono dilatare il colon e amplificare l'ipersensibilità viscerale preesistente. Batteri specifici producono anche mediatori neuroattivi (istamina, LPS, derivati del triptofano) che evocano o amplificano l'ipersensibilità viscerale attraverso percorsi che possono essere dipendenti o meno dai mastociti. Anche le cellule intermedie (ad es. enterociti, cellule enteroendocrine o altre cellule immunitarie) possono contribuire a entrambe le vie. La riesposizione agli antigeni alimentari in seguito alla perdita della tolleranza orale causata da una colite infettiva acuta autolimitante o da stress psicologico potrebbe anche portare all'attivazione dei mastociti IgE-dipendente e all'ipersensibilità viscerale."
Altri attivatori dei sintomi possono essere cibi grassi, tramite lo stimolo motorio, alcune componenti del grano come il glutine e gli inibitori dell'α-amilasi-tripsina
Misurare le Ig-G antigliadina potrebbe suggerire chi può avere problemi col grano ma in generale il ruolo delle Ig-G rimane controverso.
In generale le Ig-E, gli anticorpi delle allergie classiche, rimangono bassi, per cui si pensa a un coinvolgimento di altre vie per l'attivazione dei mastociti o l'aumento solo locale (nell'intestino) delle Ig-E.
Istamina e proteasi portano all'attivazione dei mastociti e a segnali immunogeni che causano l'ipersensibilità viscerale. È possibile notare come riducendo i FODMAP si riducano sia i dolori che l'istamina nelle urine.
Si pensa per questo a una risposta immune solo locale, confermata anche dall'iniezione intestinale di cibo che provoca il dolore, con perdita della tolleranza orale. La reazione può essere paragonata all'induzione di rinite allergica.
Alcune prove suggeriscono che anche lo stress psicologico può favorire la perdita della tolleranza. Non si capisce esattamente se il sistema Th2 sia coinvolto.
Il microbiota, fermentando i FODMAP, ha un ruolo importante nel dolore e nella sensibilità viscerale. La produzione di indoli e triptamina, derivati del triptofano, l'aminoacido che viene convertito anche in serotonina, dipende dai microbi del nostro intestino. La produzione di istamina da diversi batteri, in particolare da Klebsiella aerogenes, lega microbiota e dolori addominali,
Oltre all'istamina anche LPS, un metabolita dei batteri gram negativi come E. coli, attiva i mastociti (attraverso PGE2, mediatore dell'infiammazione) e così i recettori del dolore dei nervi nocicettivi.
Purtroppo non abbiamo marker che possano dare indicazioni affidabili, ma una dieta personalizzata può sicuramente aiutare: capire chi possa trarre vantaggio da farmaci, probiotici e altri modi per alterare il microbiota è la sfida odierna.
Aggiornamento 10/6/2022
Interessante articolo di Hack your gut sull'istamina e il mio nuovo post sulle sensibilità alimentari legate anche all'istamina.
Aggiornamento 24/6/2022
Un simbiotico (probiotici + fibre) può essere efficace nel ridurre l'orticaria cronica in persone che non rispondono agli antistaminici
Aggiornamento 28/6/2022
Molti legami tra istamina e intestino irritabile
Aggiornamento 9/8/2022
In circa un quarto delle persone con sindrome dell'intestino irritabile (IBS) il principale responsabile potrebbe essere il batterio Klebsiella aerogenes, principale produttore di istamina. L'istamina attiva i recettori per l'ipersensibilità viscerale e può rappresentare il ponte tra immunità, infiammazione, tolleranza e dolore. Dare una dieta a ridotta quantità di fibre fermentabili riduce l'istamina dando sollievo. La ricerca dell'istamina nelle feci può essere d'aiuto.
Aggiornamento 16/8/2022
Le cellule del sistema immunitario sono sensibili alle variazioni dei ritmi circadiani, in particolare le mastcellule che producono l'istamina, mediatore dell'allergia, perché il cortisolo rilasciato al risveglio "resetta" l'orologio biologico ogni giorno.
Seguire correttamente l'andamento della giornata, fare colazione e andare a letto alla giusta ora può ridurre i sintomi dell'allergia
Seguire correttamente l'andamento della giornata, fare colazione e andare a letto alla giusta ora può ridurre i sintomi dell'allergia
Aggiornamento 20/9/2022
L'EAACI, la società europea degli allergologi, si conferma una delle società scientifiche più moderne per quanto riguarda la posizione sull'alimentazione. Ha infatti rilasciato un documento in cui si chiarisce l'importanza della fibra per la modulazione del sistema immunitario, sia per quanto riguarda la prevenzione che la gestione della tolleranza immunitaria e quindi delle allergie.
I fattori dietetici possono funzionare da "allenatori" per il sistema immunitario, e i cambiamenti nell'alimentazione degli ultimi decenni hanno un ruolo causale nell'aumento delle allergie.
Il passaggio a una dieta povera di vegetali "ha influenzato negativamente la diversità e la composizione del microbiota, le caratteristiche specie-specifiche, il metabolismo microbico e la tolleranza immunologica".
Le cellule immunitarie, tra cui quelle dendritiche che conferiscono la tolleranza, i mastociti che rilasciano istamina e le Tregs da cui derivano i linfociti attivati e polarizzati Th2 (favorenti l'allergia), hanno recettori per gli SCFA, i derivati della fibra prodotti dai batteri buoni.
Una buona quantità di fibre può essere protettiva anche dalle malattie infettive respiratorie come COVID19 in forma grave grazie alla modulazione sul microbiota.
La position si conclude sottolineando che le fibre contribuiscono al mantenimento di una mucosa tolerogenica e possono proteggere dai disturbi allergici, ma c'è ancora incertezza sul trattamento ottimale da somministrare.
Per esempio la sola presenza di fibre in caso di mancanza di alcune specie batteriche può non essere sufficiente e la migliore strategia sarebbe quella di integrare anche i probiotici. Inoltre una varietà di fibre può avere effetto migliore rispetto ad un solo tipo. Sono necessari ulteriori studi per perfezionare le conoscenze e rilasciare linee guida precise.
I fattori dietetici possono funzionare da "allenatori" per il sistema immunitario, e i cambiamenti nell'alimentazione degli ultimi decenni hanno un ruolo causale nell'aumento delle allergie.
Il passaggio a una dieta povera di vegetali "ha influenzato negativamente la diversità e la composizione del microbiota, le caratteristiche specie-specifiche, il metabolismo microbico e la tolleranza immunologica".
Le cellule immunitarie, tra cui quelle dendritiche che conferiscono la tolleranza, i mastociti che rilasciano istamina e le Tregs da cui derivano i linfociti attivati e polarizzati Th2 (favorenti l'allergia), hanno recettori per gli SCFA, i derivati della fibra prodotti dai batteri buoni.
Una buona quantità di fibre può essere protettiva anche dalle malattie infettive respiratorie come COVID19 in forma grave grazie alla modulazione sul microbiota.
La position si conclude sottolineando che le fibre contribuiscono al mantenimento di una mucosa tolerogenica e possono proteggere dai disturbi allergici, ma c'è ancora incertezza sul trattamento ottimale da somministrare.
Per esempio la sola presenza di fibre in caso di mancanza di alcune specie batteriche può non essere sufficiente e la migliore strategia sarebbe quella di integrare anche i probiotici. Inoltre una varietà di fibre può avere effetto migliore rispetto ad un solo tipo. Sono necessari ulteriori studi per perfezionare le conoscenze e rilasciare linee guida precise.
Aggiornamento 25/9/2022
Il microbiota influenza l'intolleranza all'istamina: il bilancio tra batteri degradatori e produttori (Staphylococcus e Proteus, generi non identificati delle Enterobacteriaceae, le specie Clostridium perfringens e Enterococcus faecalis) determina la presenza e l'assorbimento dell'istamina nel sangue. Quando alcuni batteri sono in eccesso l'assenza di DAO porta facilmente ai sintomi. La disbiosi porta all'infiammazione della mucosa che può ridurre la funzionalità di DAO.
Aggiornamento 3/4/2023
Aumentano le evidenze sul coinvolgimento di alcuni funghi, tra cui la candida, nei sintomi gastrointestinali e in particolare nella sindrome dell'intestino irritabile (IBS). La variante di IBS maggiormente coinvolta appare essere la D (diarroica).
Alcuni studi, ma non tutti, suggeriscono che la candida favorisce intolleranze alimentari. La sua azione, insieme a quella di altri funghi, può essere dovuta al rilascio di alcuni metaboliti, come β-mannoside, β-glucani e chitina dalla parete cellulare, candidalisina quando si sviluppa la forma di ifa. Questi componenti possono essere irritanti di per sé o stimolare il sistema immunitario
S. cerevisiae può irritare la mucosa interferendo col metabolismo delle purine e la produzione di acido urico, che aumenta l'infiammazione. I funghi possono anche produrre la prostaglandina PGE2, notoriamente infiammatoria, che inoltre riduce la risposta immunitaria favorendo la crescita di candida.
Un altro meccanismo che favorisce l'infiammazione è l'induzione di permeabilità intestinale (PI). Molte proteine, in particolare nella forma di ifa, provocano un aumento della PI, rompendo la mucina, legandosi alla parete cellulare per permettere l'ingresso (als3 e candidalisina); una volta dentro la candida consuma il glucosio e buca le cellule con le sue ife. Anche S. cerevisiae e la risposta immunitaria stimolata dalle infezioni fungine favoriscono la PI.
La stimolazione delle citochine rilasciate dalle cellule immunitarie e la degranulazione dei mastociti che rilasciano istamina sono tra i responsabili dell'aumento di sensibilità viscerale che porta al dolore nell'IBS.
S. boulardii e i lattobacilli contrastano la candida. In particolare i lattobacilli riducono l'adesione alla parete cellulare, la trasformazione in ifa grazie agli acidi grassi a catena corta e degradano la chitina. S. boulardii invece produce acido caprilico e migliora l'infiammazione, riducendo in generale la colonizzazione di candida. Il più comune S. cerevisiae invece (lievito di birra) può avere diverso effetto, positivo o negativo, a seconda del ceppo. I β-glucani possono avere un effetto positivo se integrati. Il trapianto di microbiota, i batteriofagi e il viroma rappresentano altri potenziali terapeutici. Alcuni parassiti come giardia, trichinella e Blastocystis hominis sono associati a maggior rischio di IBS.
L'articolo si conclude invitando ad arricchire le ricerche perché ancora non conclusive.
Aggiornamento 24/4/2023
Qual è la connessione neuroimmune nei disordini digestivi?
I disordini gastrointestinali funzionali come la dispepsia funzionale (FD, generici sintomi del tratto superiore) o la sindrome dell'intestino irritabile (IBS, dolori addominali generalmente presenti con alterazione dell'alvo) sono molto diffusi. Possono essere considerati anche come disturbi dell'interazione intestino-cervello e quindi condizioni altamente prevalenti con opzioni di trattamento efficaci limitate.
I neuroni sensoriali della mucosa nei pazienti con sindrome dell'intestino irritabile sono sensibilizzati attraverso un aumento del rilascio di mediatori del dolore (nocicettivi) dalle cellule immunitarie e dall'epitelio.
Una sottile infiltrazione e attivazione di mastociti ed eosinofili, entrambi fonte di mediatori nocicettivi, sono state dimostrate nella sindrome dell'intestino irritabile e nella dispepsia funzionale.
Lo stress psicologico, i componenti alimentari, il microbiota e una funzione di barriera compromessa possono tutti contribuire all'attivazione immunitaria nei disturbi gastrointestinali funzionali.
Per varie ragioni, tra cui alterazioni nei recettori TRPV1 e del sistema nervoso enterico, le persone con queste condizioni hanno aumentata risposta viscerale (iperalgesia) e sono quindi più sensibili agli stimoli e sentono più dolore.
Diventa sempre più evidente che le condizioni siano caratterizzate da un'attivazione dell'immunità a livello della mucosa e conseguente infiammazione.
Si riscontra infatti infiltrazione di diversi tipi di globuli bianchi (monociti, linfociti T e mastociti). Questi ultimi sono particolarmente importanti perché rilasciano istamina, il mediatore dell'allergia.
L'infiltrazione può iniziare anche dopo semplici gastroenteriti virali.
Cosa provoca l'attivazione del sistema immunitario intestinale?
1) la permeabilità intestinale. "La barriera ha la duplice funzione di proteggere l'organismo dalla penetrazione indesiderata di sostanze luminali potenzialmente nocive, inclusi agenti patogeni e loro prodotti secreti, consentendo allo stesso tempo l'assorbimento di fluidi e (micro)nutrienti. La barriera svolge anche un ruolo fondamentale nella soppressione dell'attivazione immunitaria nei confronti di antigeni innocui ingeriti per via orale, principalmente alimentari, in un processo definito come tolleranza orale. Per ottenere la tolleranza orale, gli antigeni luminali vengono campionati da cellule microfold (M) in placche di Peyer, macrofagi della mucosa o cellule caliciformi, successivamente acquisiti da cellule dendritiche tollerogeniche che poi migrano verso i linfonodi mesenterici con induzione di cellule T regolatrici immunosoppressive.
Si ipotizza spesso che l'alterata funzione di barriera consenta la penetrazione incontrollata degli antigeni nella lamina propria, stimolando una risposta immunitaria. Tuttavia, se l'aumento della permeabilità svolga un ruolo causale in queste condizioni o sia piuttosto una conseguenza dell'attivazione immunitaria rimane un argomento controverso".
2) il cibo. È ben noto che alcuni cibi, quelli ricchi in zuccheri fermentabili FODMAP per esempio, stimolano i sintomi, creando gas e distensione addominale. In realtà esistono anche reazioni di tipo immunitario in cui gli antigeni stimolano la reazione dei mastociti e degli eosinofili, mediatori dell'allergia. Nelle allergie classiche si notano gli anticorpi Ig-E contro il cibo. Tuttavia nelle persone con IBS e FD gli anticorpi Ig-E possono non essere presenti nel sangue. "Questi risultati suggeriscono che sia coinvolta l'attivazione di eosinofili/mastociti non IgE-mediata o una reazione IgE-mediata confinata alla mucosa gastrointestinale". In particolare gli autori della review sono sostenitori di quest'ultima ipotesi, in cui i mastociti medino queste allergie, trovandosi vicino alle terminazioni nervose e inducendo dolore.
3) il microbiota. Le prove dell'interazione tra batteri intestinali e IBS aumentano ma il quadro non è ancora completo. Sicuramente la produzione di metaboliti amminoacidici quali istamina, serotonina e triptamina contribuisce all'infiammazione e al dolore.
L'istamina è particolarmente importante nell'induzione del dolore. Un ceppo particolare di Klebsiella aerogenes produce 100 volte più istamina dei comuni ceppi batterici. La dieta FODMAP può ridurre l'istamina.
4) condizioni psicologiche. Stress, ansia e depressione sono noti per peggiorare i sintomi di IBS. Questo succede aumentando l'istamina e il CRH, ormone dello stress rilasciato anche dagli eosinofili e che attiva i mastociti, determinando tra le altre cose incremento della permeabilità intestinale.
Le opzioni farmacologiche sono scarse. Per esempio in caso di esofagite eosinofila gli antiacidi hanno un effetto antinfiammatorio ma nel lungo periodo i vantaggi sono superati dagli svantaggi (peggioramento della disbiosi). Cortisonici e mesalazina non hanno dato buoni risultati. Antistaminici e antiserotoninergici hanno mostrato efficacia ma con alcuni effetti collaterali.
La collaborazione tra i diversi professionisti sarà fondamentale per trovare cure adeguate.
Aggiornamento 30/4/2023
Da diverso tempo penso che l'EAACI, la società europea di allergologia, sia una delle società scientifiche più avanti di tutte.
In una recente posizione hanno illustrato come le fibre alimentari possano modulare il sistema immunitario e prevenire, alleviare e in qualche caso guarire malattie legate alle sue alterazioni come allergie, asma e malattia infettive, compreso COVID19.
Le fibre sono componenti essenziali dell'alimentazione e le allergie sono cresciute contemporaneamente al declino del loro consumo. Le fibre contribuiscono a mantenere la tolleranza immunologica attraverso la fermentazione microbica e la produzione di metaboliti batterici. Per questo la fibra può non essere sufficiente ma può essere necessario integrare le specie batteriche mancanti coi probiotici. È probabile che un tipo di fibra da solo sia inefficace, quindi il vantaggio si avrebbe dal corretto mix delle diverse fibre presenti in vari alimenti vegetali.
Potrebbe essere importante classificare le fibre in base al loro effetto immunitario. Per esempio promozione dell'integrità della barriera epiteliale, induzione delle cellule T regolatorie, prevenzione della polarizzazione TH2 e inibizione della degranulazione dei mastociti (rilascio di istamina).
Anche il timing di esposizione è importante, per cui sin da piccoli ci si deve abituare a mangiare fibre per modulare l'immunità. Alcune linee guida stabiliscono l'utilità della supplementazione con fibre in bambini a rischio malattie allergiche. Diversi studi mostrano l'utilità delle fibre nella gestione di allergie, dermatite atopica e asma, mostrando quindi un potenziale uso farmacologico dell'alimentazione. Ulteriori studi sono necessari per chiarire le varie interazioni tra microbiota, fibre e sistema immunitario.
Aggiornamento 22/11/2023
Nuove classificazioni nelle allergie, secondo l'EAACI.
Nel nuovo position paper dell' EAACI (Società Europea di Allergologia) si individuano e classificano 7 tipi di sensibilità allergica, 3 in più rispetto alle 4 già conosciute.
Si tratta di un passo avanti in quanto le sensibilità di tipo V e VI sono ritenute fortemente legate alla disbiosi e alla permeabilità degli epiteli (non solo intestinale ma anche di pelle e altre mucose). Viene chiaramente sottolineato che queste condizioni sono legate ad allergia, asma, malattie autoimmuni, dermatite atopica, rinosinusite, esofagite eosinofila, obesità e metabolismo alterato. L'alterata permeabilità è anche strettamente legata alla dieta (povertà di fibre e riduzione del muco protettivo), ma anche a fattori ambientali come inquinamento e prodotti di uso comune, inclusi dentifrici, shampoo, detersivi e alimenti trasformati.
Si tratta di un passo avanti in quanto le sensibilità di tipo V e VI sono ritenute fortemente legate alla disbiosi e alla permeabilità degli epiteli (non solo intestinale ma anche di pelle e altre mucose). Viene chiaramente sottolineato che queste condizioni sono legate ad allergia, asma, malattie autoimmuni, dermatite atopica, rinosinusite, esofagite eosinofila, obesità e metabolismo alterato. L'alterata permeabilità è anche strettamente legata alla dieta (povertà di fibre e riduzione del muco protettivo), ma anche a fattori ambientali come inquinamento e prodotti di uso comune, inclusi dentifrici, shampoo, detersivi e alimenti trasformati.
- Le reazioni di tipo I, IgE-dipendenti, si verificano in pazienti con rinite allergica (AR), rinocongiuntivite allergica (ARC), asma, dermatite atopica, orticaria acuta/angioedema, allergie alimentari, al veleno e ai farmaci. Sono immediate.
- Le reazioni di tipo II sono tipicamente reazioni indotte da farmaci che sono considerate causa di citopenia allergica. Tuttavia, le reazioni di tipo II rappresentano un evento patogenetico essenziale in diverse malattie autoimmuni, come la trombocitopenia immune, l'anemia emolitica autoimmune (AIHA), la neutropenia autoimmune, la malattia di Biermer, la sindrome di Goodpasture, la malattia emolitica del feto e del neonato (eritroblastosi fetale), la miastenia gravis, pemfigo e reazioni trasfusionali che coinvolgono gruppi sanguigni non corrispondenti.
- Le reazioni allergiche di tipo III comprendono la fase acuta della polmonite da ipersensibilità (detta anche alveolite allergica estrinseca), la vasculite indotta da farmaci, la malattia da siero e la reazione di Arthus. Le reazioni di tipo III sono associate a diverse malattie autoimmuni, tra cui il lupus eritematoso sistemico (LES), l'artrite reumatoide (RA) e la glomerulonefrite post-streptococcica.
- Risposta immunitaria di tipo IVa – T1 Le manifestazioni cliniche tipiche della reazione di tipo IVa sono la dermatite allergica da contatto, la fase cronica della polmonite da ipersensibilità (detta anche alveolite allergica estrinseca) e la malattia celiaca. Le reazioni di tipo IVa possono essere essenziali anche per gli endotipi di asma non T2, AR, CRS o AD. Questi meccanismi spiegano anche le reazioni allergiche non immediate ai farmaci, che si verificano dopo l'aptenizzazione del farmaco con una proteina trasportatrice.
- L'espressione più caratteristica di una reazione di ipersensibilità di tipo IVb può essere osservata nella classica reazione allergica con infiammazione cronica delle vie aeree nell'AR, nella rinosinusite cronica (CRS), nell'asma e nell'AD (endotipo T2), nell'allergia alimentare, nell'esofagite eosinofila (EoE) o nella dermatite da contatto con proteine. Le cellule Th2, ILC2, le cellule NK-T, gli eosinofili e un sottoinsieme di Mφ sono i principali attori della risposta immunitaria di tipo IVb – T2. Le reazioni di tipo IVb sono mediate dalle cellule Th2, che acquisiscono il loro fenotipo in seguito all'esposizione a IL-4, basofili o cellule NK-T.8
- Nelle risposte di tipo IVc, le cellule Th17, che appartengono alla linea delle cellule T helper, producono citochine della famiglia IL-17 che regolano gli effettori innati e orchestrano l'infiammazione locale inducendo il rilascio di citochine e chemochine proinfiammatorie in grado di reclutare NEU e migliorare la produzione di citochine Th2 . Le cellule Th17 della memoria acquisiscono il loro fenotipo in seguito all'esposizione a IL-6, IL-21, IL-23 e TGF-β forniti dalle APC. Le principali citochine effettrici prodotte dalle cellule Th17 sono IL-17A, IL-17F, IL-21, IL-22 e il fattore stimolante le colonie di granulociti-Mφ
- Tipo V: difetto della barriera epiteliale. Negli ultimi anni sono stati compiuti progressi significativi nella comprensione dei diversi fenotipi ed endotipi delle malattie infiammatorie della mucosa/cutanea come AR/ARC cronica, CRS, AD, asma o sindrome da enterocolite indotta da proteine alimentari, EoE e malattia celiaca. Ciò ha rivelato che queste condizioni non sono malattie omogenee ma sono invece definite da una costellazione di sintomi che possono derivare da diversi meccanismi patologici. In alcuni casi, il processo infiammatorio sembra riflettere un'alterata funzione di barriera della pelle o della mucosa, piuttosto che da un disregolazione immunitaria primaria. La compromissione della funzione della barriera epiteliale facilita l'attivazione del sistema immunitario sottostante e successivamente porta all'infiammazione cronica. La perdita della barriera può derivare da difetti in diversi componenti essenziali, tra cui elementi strutturali dello strato corneo nella pelle, proteine di giunzione stretta nella pelle e nelle mucose, antiproteasi protettive, espressione di prodotti antimicrobici, trasporto di ioni, protoni, acqua o materiali antimicrobici e altri meccanismi. L’attivazione dei nervi sensoriali, che contribuisce allo sviluppo dei sintomi allergici, è anche associata alla perdita della barriera. La disfunzione della barriera intestinale può verificarsi anche attraverso l’erosione del muco attraverso un’alimentazione/dieta a basso contenuto di fibre. Ciò spiega per la logica dell'introduzione dell'ipersensibilità di tipo V per evidenziare le peculiarità dei processi patologici e per la loro importanza nell'ottica di approcci personalizzati e di precisione alla caratterizzazione di endotipi e biomarcatori e al trattamento biologico in rapido sviluppo, in particolare con anti-allarmine. I fenomeni di alterazione delle barriere inducono anche infiammazione attraverso l'attivazione del sistema immunitario tramite reazione di tipo IVb. Essendo un fattore importante nell'ipersensibilità di tipo V, il coinvolgimento diretto di fattori ambientali che interrompono direttamente le barriere epiteliali è stato recentemente dimostrato in diversi modelli e tessuti umani. L'esposizione diretta a inquinanti atmosferici, sostanze chimiche e altri fattori ambientali nell'esposoma può distruggere le barriere epiteliali e influenzare il microbioma e il sistema immunitario. È noto che molti degli agenti chimici presenti nei comuni prodotti di consumo (compresi dentifricio, shampoo, detersivi e alimenti trasformati) danneggiano queste barriere critiche, aumentando la permeabilità a batteri, tossine, sostanze inquinanti e allergeni. Quando le barriere epiteliali vengono danneggiate (diventando 'leaky', permeabili), sostanze e microbi possono passare nei tessuti più profondi, dove normalmente non appartengono e innescare una risposta immunitaria/infiammatoria che può avviare o aggravare molte malattie infiammatorie croniche attraverso le vie dell'inflammasoma I difetti della barriera epiteliale sono stati dimostrati non solo in T2 ma anche nelle risposte non-T2 nella rinosinusite cronica con poliposi nasale (CRSwNP) e nell'asma non-T2. Recenti studi sull'esposizione in modelli murini di infiammazione polmonare eosinofila nell'asma e nello sviluppo di esofagite eosinofila in risposta al sodio lauril solfato e ai detergenti dimostrano che l'asma e l'infiammazione simile a (EoE) iniziano solo con l'attivazione delle cellule epiteliali e la perdita della barriera indotta da sostanze tossiche. Come esempio diretto di citotossicità chimica, gli individui con barriere epiteliali permeabili mostrano un'infiammazione locale nelle loro cellule epiteliali, denominata "epitelite". L’epitelite è l’evento iniziale che attira le cellule proinfiammatorie nell’area della barriera epiteliale danneggiata. Si inizia con gli insulti ambientali (esposizione a sostanze inquinanti e tossiche), infezioni virali ed enzimi negli allergeni. Principalmente le allarmine, IL-25, IL-33 e TSLP e numerose chemochine proinfiammatorie vengono rilasciate dalle cellule epiteliali che invitano il sistema immunitario, nell'area, in particolare il Tipo IVb e i soggetti della risposta T2. La disbiosi microbica si verifica in aree della barriera epiteliale infiammatoria che risulta permeabile. Un microbiota sano sulla superficie della barriera mucosa regola numerosi aspetti dell’omeostasi della barriera. Tuttavia, la ridotta biodiversità e le alterazioni nella composizione e nel metabolismo del microbiota intestinale e cutaneo sono associati a varie condizioni infiammatorie, tra cui asma, malattie allergiche, malattie infiammatorie intestinali, diabete di tipo 1 e obesità. La disbiosi si riferisce a uno squilibrio nei microrganismi che risiedono nei tessuti, con disbiosi microbica e traslocazione batterica legate allo sviluppo e all’esacerbazione di malattie allergiche e autoimmuni.
- Tipo VI – disregolazione immunitaria indotta dal metabolismo. Particolarmente presente negli obesi asmatici che diventano resistenti al cortisone, anche questa coinvolge il microbiota e la permeabilità intestinale, con mancata degradazione dell'istamina. Le sostanze che entrano dall'intestino vanno, attraverso la circolazione sanguigna, a infiammare i tessuti distanti aumentando il rischio di malattie croniche incluso, malattie autoimmuni, asma e allergie. "Recentemente sono stati identificati numerosi nuovi metaboliti immunomodulanti (ad esempio metaboliti del triptofano, acidi grassi a catena corta) e la secrezione disregolata di questi immunomodulatori può contribuire allo sviluppo di allergie".
- Tipo VII: risposta cellulare e infiammatoria diretta alle sostanze chimiche. Le reazioni di tipo VII si verificano in pazienti con AR, ARC, asma, AD, orticaria acuta/angioedema e allergia ai farmaci. Può essere dovuta all'uso di FANS (aspirina) che alterano il metabolismo dell'acido arachidonico.
Aggiornamento 28/2/2024
Il dolore viscerale che si ha nell'intestino irritabile è legato anche all'alterazione del microbiota e alla produzione di istamina (mediatore dell'allergia) in seguito all'introduzione di antigeni alimentari che attivano i mastociti. Si può in un certo senso anche classificare come disordine dell'asse intestino-cervello, in cui le vie nocicettive (percezione del dolore) sono eccessivamente attivate. Anche lo stress gioca un ruolo importante.
Altre vie coinvolte sono quelle degli oppioidi, dei TRPV1, dei cannabinoidi, del GABA e della serotonina (kinurenina).
Aggiornamento 16/3/2023
La sindrome di Behçet è una malattia autoimmune complessa e multicausale che si presenta come vasculite ma colpisce spesso mucose, pelle, occhi e articolazioni. Nella sua eziologia rientrano "agenti infettivi e microbiota, genetica ed epigenetica, disfunzione del sistema immunitario e ulteriori fattori ambientali".
Tra i batteri associati, alcuni streptococchi e Mycobacterium tuberculosis, mentre tra i virus quello dell'herpes (tipo 1). Si rilevano inoltre carenze di Roseburia, Subdoligranulum e Clostridum, batteri che producono butirrato.
Può l'alimentazione modulare la malattia?
Gli alimenti acidi, speziati e istaminoliberatori possono attivare la malattia, in particolare le ulcere orali. La carenza di butirrato induce una riduzione delle cellule Treg che favoriscono la tolleranza immunitaria. Alcuni studi hanno evidenziato l'utilità di questo acido grasso a catena corta. "Sulla base di queste evidenze, le diete arricchite di butirrato potrebbero essere utili nel trattamento della sindrome di Behçet".
Aggiornamento 24/5/2024
L'orticaria cronica (CSU) è un disturbo che può non essere controllato dagli antistaminici in oltre la metà dei casi, ma può rispondere all'alimentazione.
I punti salienti di una revisione degli studi sono:
"L’allergia alimentare è una causa estremamente rara di CSU, mentre in alcuni pazienti può essere associata una sensibilità (intolleranza) alimentare (definita come pseudoallergia).
I componenti o le sostanze alimentari che possono provocare intolleranze alimentari sono chiamati pseudoallergeni. Questi sintomi sono reazioni di ipersensibilità che possono simulare vere reazioni allergiche e sono oggettivamente riproducibili in esposizioni ripetute. Tra gli pseudoallergeni degni di nota figurano alimenti ricchi di istamina o che attivano i mastociti come formaggio, pesce, frutti di mare, verdure come pomodori, frutta, cioccolato, alcol, alcuni farmaci, erbe e spezie, additivi alimentari come rosso cocciniglia, azorubina, carminio, rosso allura ed eritrosina. Questi prodotti alimentari possono innescare o peggiorare la CSU in modo dose-dipendente. Recentemente, diversi autori hanno segnalato che l'orticaria da contatto causata da alcuni alimenti può essere una causa di tali reazioni. L'intolleranza alimentare viene solitamente sospettata quando i sintomi clinici migliorano dopo 3 settimane di dieta di eliminazione rigorosa, o se i test provocativi orali (OPT) con sostanze implicate aggravano i sintomi
Nel complesso, le diete di eliminazione hanno prove inferiori rispetto alle diete integrate con alcuni supplementi come terapia aggiuntiva, poiché le prime mancano di studi randomizzati e controllati.
L’eliminazione degli additivi alimentari e le diete personalizzate possono essere utili in un sottogruppo di pazienti senza alcun test per predire la risposta, mentre integratori alimentari come vitamina D, diaminoossidasi (enzima degradatore dell'istamina) e probiotici possono essere utili in caso di carenze specifiche.
La restrizione generalizzata di alimenti, senza test di provocazione, è fortemente scoraggiata.
Le diete di eliminazione devono essere continuate per almeno 3 settimane per valutare la risposta, mentre in caso di carenze devono essere somministrati integratori alimentari finché i livelli sierici non ritornano normali".
In generale le maggiori evidenze sono per la dieta a basso contenuto di istamina, per quella personalizzata e per l'eliminazione degli additivi. Per gli integratori l'uso di vitamina D e probiotici e simbiotici.
La ricerca si conclude invitando a rivolgersi a un nutrizionista per la personalizzazione della dieta
Aggiornamento 3/7/2024
La SIBO è data dall'eccesso di batteri presenti nella prima parte dell'intestino.
La SIBO può essere sovradiagnosticata con i metodi attuali da laboratorio (breath test al lattulosio o glucosio). Questo può portare a uso inappropriato di antibiotici. Inoltre non è necessariamente presente in caso di IBS, può comunque esserne una causa.
Non solo l'eccesso di batteri però può dare problemi, bisogna considerare anche la complessa interazione con acidi biliari e succhi gastrici.
Nuovi test potrebbero semplificare e migliorare la diagnosi di SIBO
Aggiornamento 4/11/2024
Si rivelano utili, in particolare i mix di lattobacilli e bifidobatteri, nel migliorare la QOL delle persone affette da intestino irritabile (IBS). In particolare "Bifidobacterium infantis 35624 ha dimostrato un notevole miglioramento nell'alleviare il disagio/dolore addominale, gonfiore/distensione e/o difficoltà di movimento intestinale rispetto al placebo.
Sono efficaci anche nella riduzione della stipsi funzionale, condizione che determina riduzione della QOL soprattutto negli anziani.
Per quanto riguarda le persone con tumore, servono studi più grandi per verificare l'efficacia nei confronti della "fatigue" e della riduzione degli effetti collaterali gastrointestinali delle terapie.
Aggiornamento 10/12/2024
Alcuni aggiornamenti su sensibilità e intolleranze alimentari
La sensibilità al grano (o al glutine) non celiaca, è relativa a un meccanismo immunitario che non coinvolge le allergie classiche. L'attivazione immunologica riguarda il sistema innato, lo stesso attivato dai batteri patogeni mediante il TLR2 e 4. È quindi probabile un coinvolgimento del microbiota alterato e della permeabilità intestinale. Non esistono test attendibili per diagnosticarla, se non con una temporanea eliminazione e reintroduzione. Può dare sintomi intestinali ed extraintestinali (come stanchezza, mal di testa, sensazione di confusione mentale e depressione), e può essere dovuta sia al glutine che ad altre sostanze presenti nel grano e simili. Il glutine, mal digerito per la presenza di molti residui di prolina resistenti ai nostri enzimi, dà luogo alla formazione di peptidi immunogenici che creano stress ossidativo. Anche gli inibitori dell'amilasi-tripsina (ATI) "disturbano" i nostri enzimi digestivi e determinano infiammazione e attivazione dell'immunità. Inoltre anche i FODMAP presenti nei grano possono determinare sintomi intestinali. Il quadro è per questo complesso e difficilmente comprensibile. La dieta è comunque il miglior approccio.
I FODMAP (zuccheri fermentabili) sono una nota causa di problemi intestinali. La loro rimozione deve essere fatta seguiti da un esperto. Devono essere inoltre reintrodotti in quantità accettabili perché la loro esclusione a lungo termine rischia di impoverire il microbiota, portare a costipazione e altri problemi.
Il lattosio è causa di intolleranza riscontrata con il test di malassorbimento, che comunque non è affidabile al 100%. Lo zucchero non digerito viene fermentato dai batteri e induce dolore addominale, gonfiore e diarrea. Alcuni hanno paradossalmente stipsi o problemi extraintestinali.
"Le opzioni terapeutiche comprendono una serie di approcci, tra cui l’adozione di una dieta a basso contenuto di lattosio, l’uso di sostituti orali dell’enzima lattasi, l’impiego di probiotici per stimolare la produzione batterica di lattasi nel colon e potenzialmente l’impiego di prebiotici per modificare il microbiota del colon". Tra i probiotici, Limosilactobacillus reuteri DSM 17938 (Lactobacillus reuteri), e Lactobacillus acidophilus DDS-1 appaiono i migliori, tra le fibre i GOS (promuovono la proliferazione di bifidobatteri). La dieta con poco lattosio può essere tollerata dalla maggior parte delle persone.
L'intolleranza al fruttosio ereditaria include un difetto nel metabolismo cellulare del fruttosio. Il trattamento prevede di evitare fruttosio, sorbitolo e saccarosio.
La compliance alla dieta è fondamentale per garantire un'aspettativa di vita corretta. Il fruttosio infatti crea in queste persone danno renale ed epatico perché non metabolizzato. In acuto può portare a problemi blandi come nausea e disconfort intestinale, ma anche acidosi e ricovero in terapia intensiva.
Dato che la riduzione del consumo di frutta e verdura è un "requisito dietetico", si consiglia l'integrazione quotidiana con un multivitaminico per prevenire carenze di micronutrienti, in particolare di vitamine idrosolubili, soprattutto la C.
L'intolleranza al fruttosio non ereditaria è invece legata alla difficoltà dell'intestino ad assorbire il fruttosio, che è un FODMAP.
L'intolleranza all'istamina (HIT) è legata a un difetto di degradazione dell'istamina proveniente dalla dieta (o formatasi durante la digestione). L'istamina determina l'attivazione di diverse vie, comprese immunitarie.
"L'istamina viene metabolizzata attraverso due vie: metilazione da parte dell'istamina N-metiltransferasi (HNMT), presente nella maggior parte dei tessuti corporei, e degradazione ossidativa da parte della diammina ossidasi (DAO), che è un enzima secretorio situato principalmente nella mucosa dell'intestino tenue e nei reni. Un’elevata disponibilità di istamina può derivare da vari fattori, tra cui la sovrapproduzione endogena di istamina dovuta ad allergie, mastocitosi, sanguinamento gastrointestinale o maggiore assunzione di istidina o istamina dal cibo o dall’alcol. Tuttavia, le prove attuali relative all’aumento dei livelli plasmatici di istamina nei pazienti con intolleranza all’istamina sono limitate. Una proposta recente suggerisce inoltre che l’HIT possa derivare da un’alterazione del microbiota intestinale con una maggiore abbondanza di batteri che secernono istamina nell’intestino".
La ridotta attività di DAO è la probabile causa di intolleranza e può essere dovuta a difetto genetico o fattori ambientali (farmaci, permeabilità intestinale). Non esistono metodi diagnostici accettati.
La dieta a basso contenuto di istamina è quella raccomandata, ma in realtà non esistono forti prove da RCT sull'efficacia. Inoltre le liste di vari lavori non corrispondono e alcuni alimenti come spinaci, ananas e frutta secca, pur avendo poca istamina, stimolano il suo rilascio dai mastociti.
L'uso dell'enzima DAO esogeno e degli antistaminici spesso è consigliato come cura complementare.
Aggiornamento 20/3/2025
Che connessione c'è tra stress e dolori nell'intestino irritabile? Lo stress porta all'attivazione del sistema immunitario con un reazione simil-allergica, innescata dall'asse HPA (risposta allo stress).
"Lo stress psicologico innesca una risposta immunitaria di tipo 2 a un antigene alimentare che porta alla sensibilizzazione dei mastociti. La riesposizione a questo antigene alimentare determina l'attivazione dei mastociti e un aumento della segnalazione del dolore sia nell'intestino tenue che nel colon. È importante sottolineare che non vi è stata alcuna risposta sistemica all’antigene alimentare in linea con i sintomi specifici dell’intestino indotti dal cibo sperimentati da molti pazienti con IBS".
In pratica la risposta allergica non è classica ma si manifesta come dolori addominali (ipersensibilità viscerale). Lo stress è capace di cambiare la fisiologia intestinale e la risposta immunitaria.