Un articolo di Nature fa chiarezza sui legami tra allergie, sensibilità alimentari e microbiota.
Ricordiamo che per sensibilità intendiamo quelle reazioni che coinvolgono il sistema immunitario e che sono dovuta ad una perdita di tolleranza immunitaria. Sfortunatamente gli esperti hanno deciso di attribuire il termine intolleranza solo a quelle dovute a carenze enzimatiche che non coinvolgono il sistema immunitario (intolleranza al lattosio), nonostante la perdita di tolleranza sia una caratteristica fondamentale delle sensibilità.
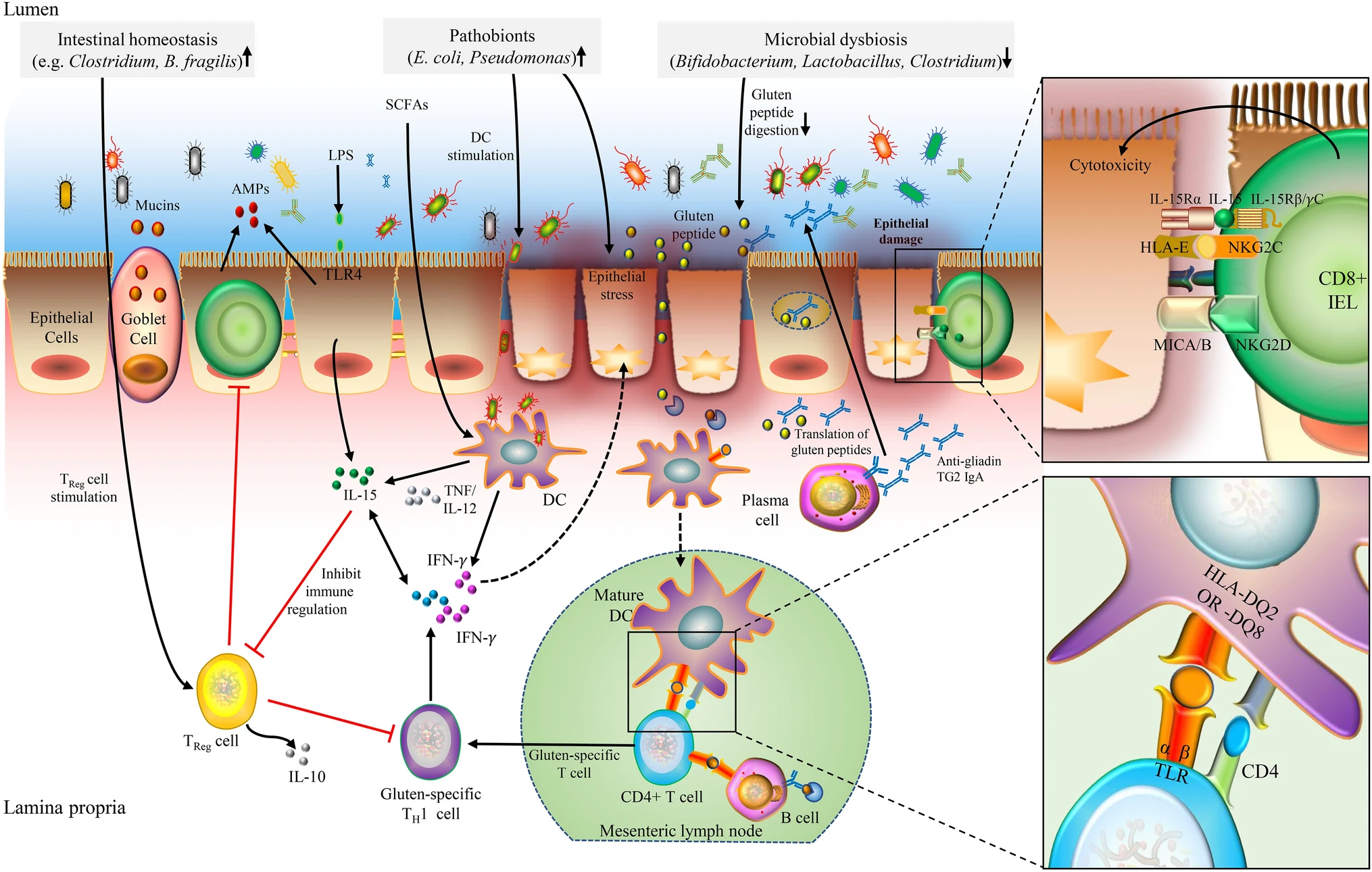
Tra queste, la sensibilità al glutine, che in realtà comprende una risposta infiammatoria dovuta non solo al glutine ma anche a fruttani e inibitori dell'amilasi-tripsina.
Il glutine ha una struttura particolarmente ricca di prolina e glutammina che non viene digerita dagli enzimi dei mammiferi, tra cui l'uomo.
Queste risposte sono certamente dovute a fattori ambientali (tipi di grano, lievitazione, tipo di microbi intestinali, ecc), dato che la nostra genetica è praticamente immutata da millenni.
In particolare il microbiota ha la capacità di modificare la struttura chimica di numerose molecole alimentari, tra cui allergeni e antigeni. Queste modifiche possono avvenire sia in meglio che in peggio, ossia diminuendo o aumentando l'immunogenicità, a seconda della flora.
Ad esempio il glutine non digerito porta alla formazione di complessi antigenici che vengono fermentati dai batteri. Se abbiamo i batteri giusti, lattobacilli soprattutto, lo tolleriamo, sennò possono essere dolori. Per citarne uno, Pseudomonas aeruginosa, un patogeno opportunista, non annulla l'immunogenicità.
La scarsità di lattobacilli potrebbe essere una concausa scatenante della celiachia.
Continua l'articolo "sta iniziando ad emergere la nozione che la composizione microbica sia una chiave nel modulare l'immunogenicità degli antigeni dietetici. Questo aspetto potrebbe applicarsi ad altre sensibilità alimentari, così come a molti allergeni alimentari, come proteine di uova e arachidi, che sono resistenti alla degradazione da parte delle proteasi dei mammiferi".
"Si è dimostrato che prodotti metabolici batterici come gli SCFA (grassi a catena corta) o i metaboliti derivati dal triptofano regolano direttamente la funzione immunitaria della mucosa e la barriera intestinale, che influenza la predisposizione alla sensibilità alimentare. Specificamente, alterazioni di questi metaboliti sono stati descritti in pazienti con sensibilità alimentare".
Nelle sensibilità alimentari il ruolo della permeabilità intestinale assieme all'alterazione dell'immunità innata (sono coinvolte cellule linfoidi) è fondamentale. Alla faccia di chi pensa che non esista un problema di passaggio di molecole non digerite nel flusso sanguigno.
Anche alcuni virus intestinali possono avere un ruolo, così come la candida (fungo), che promuove la permeabilità.
I vermi paradossalmente possono fare bene a chi soffra di allergie, modulando il sistema Th-1/Th2. Anni fa, a causa delle peggiori condizioni igieniche, era abbastanza normale avere vermi intestinali. Il fatto che oggi siano poco diffusi paradossalmente può essere una causa dell'esplosione delle allergie.
I vermi paradossalmente possono fare bene a chi soffra di allergie, modulando il sistema Th-1/Th2. Anni fa, a causa delle peggiori condizioni igieniche, era abbastanza normale avere vermi intestinali. Il fatto che oggi siano poco diffusi paradossalmente può essere una causa dell'esplosione delle allergie.
Aggiornamento 27/9/2018
La sovracrescita intestinale di candida può aumentare la risposta asmatica. Anche un altro fungo (W. mellicola) pare avere lo stesso effetto
Aggiornamento 1/10/2018
Nel modello animale, esporre i topolini ai batteri tipici degli animali da fattoria riduce la tendenza all'asma, "addomesticando" il sistema immunitario
Aggiornamento 1/10/2018
Aggiornamento 7/10/2018
In uno studio una quindicina di donne con Hashimoto hanno tratto benefici da una dieta senza glutine fatta per 6 mesi. Si tratta ovviamente di numeri piccoli ma che confermano un legame tra dieta e tiroide
Aggiornamento 12/11/2018
I probiotici possono aiutare le persone celiache a stare meglio
"La sensibilità chimica multipla (MCS) è un'entità clinica complessa che include un gran numero di sintomi non specifici, associati in modo univoco in ciascun paziente e scatenati dall'esposizione a varie sostanze chimiche a basse concentrazioni, ben al di sotto di quelle note per causare effetti tossici. Tuttavia, al momento non esiste alcun test oggettivo per diagnosticare questa sindrome. Uno dei motivi principali è che la fisiopatologia è poco conosciuta. Tuttavia, sono state proposte molte ipotesi esplicative.
La mancanza di comprensione dei meccanismi patofisiologici rende il trattamento difficile ed empirico".
Le sostanze chimiche note per innescare la MCS includono più frequentemente pesticidi e composti organici volatili (VOC) come profumi, vernici, aerosol, detergenti e formaldeide dai mobili, dagli edifici sul posto di lavoro o da materiali edilizi.
Le alterazioni nelle citochine viste in un campione di persone suggeriscono un'infiammazione sistemica associata al sistema Th2 ma che non coinvolge i meccanismi mediati dalle IgE.
La sensibilità neurologica è comunemente riportata tra le persone con MCS. La teoria più antica e più ampiamente accettata che spiega la fisiopatologia di questa reazione è la teoria dell'ossido nitrico/perossinitrito. È stato proposto che l'esposizione a sostanze chimiche tossiche attivi i recettori N-metil-D-aspartato (NMDA) nell'ippocampo, portando ad un aumento dei livelli di ossido nitrico e perossinitriti. Questi radicali liberi generano stress ossidativo e aumentano le citochine infiammatorie, iniziando l'infiammazione sistemica di basso grado e l'infiammazione neurologica.
Ma perché le sostanze chimiche tossiche potrebbero stimolare l'attività dei recettori NMDA in alcuni individui, ma non in altri? La genetica può fornire una spiegazione. I ricercatori hanno identificato specifici polimorfismi genetici che possono essere associati a una disintossicazione chimica inadeguata, aumentando il rischio individuale di sviluppare MCS.
Spesso la MCS coesiste con condizioni psichiatriche, perdita di energia, difficoltà di concentrazione, sentimenti depressivi, disturbi della memoria e affaticamento, inducendo alcuni a credere che questa condizione sia psicogena. Tuttavia, l'aumentata attività NMDA è legata alla memoria e ai disturbi dell'apprendimento, con psicosi e, in definitiva, con lesioni cerebrali eccitotossiche.
Il primo passo per aiutare le persone con MCS è identificare correttamente la condizione, seguita dalla comprensione del ruolo delle citochine infiammatorie e della disregolazione del neurotrasmettitore. Identificare i polimorfismi genetici specifici per MCS può essere utile per confermare una diagnosi.
Per gestire la MCS si deve iniziare a ridurre il carico complessivo di tossine, che si trova in casa e nell'ambiente di lavoro, negli alimenti, nei detergenti e nei prodotti per la cura del corpo. Successivamente, è importante concentrarsi sulla down-regolazione del ciclo di ossido nitrico e perossinitrito".
Aggiornamento 19/11/2018
Purtroppo in italia rigide regole non lo permettono, ma per i nati da parto cesareo sarebbe opportuno praticare il "vaginal seeding", il trasferimento del microbiota vaginale tramite l'uso di un batuffolo di cotone o simili, per favorire l'impianto nell'intestino dei microbi corretti (come in caso di parto naturale) e non quelli della pelle.
Il parto cesareo aumenta il rischio di asma, allergie, eczema, obesità ecc
Aggiornamento 21/11/2018
Nelle persone predisposte, il glutine e il cibo industriale accentuano i problemi dell'umore.
Per intraprendere una dieta senza glutine viene comunque consigliato di recarsi da un esperto per non andare incontro a carenze
Aggiornamento 30/11/2018
Due ceppi di lattobacilli (fermentum e paracasei) riducono l'asma nei bambini. Altri nutrienti utili sono vitamina C, D, magnesio e omega 3.
Aggiornamento 19/12/2018
La fatica cronica è frequente nelle persone con malattie infiammatorie intestinali (IBD), e può essere dovuta a carenze di micronutrienti, spesso come risultato di una riduzione dell'assunzione o del malassorbimento, a causa di infiammazione del lume intestinale o alterata anatomia post-chirurgica.
Le più comuni sono ferro, vitamina B12 e D, e correggere queste carenze può migliorare la condizione di fatica cronica.
Spesso risultano alterati anche metaboliti del triptofano, con conseguente alterazione dei neurotrasmettitori e dell'umore, e i microbi intestinali.
"Il microbiota intestinale nell'IBD è caratterizzato da ridotta diversità batterica; una riduzione dell'abbondanza di popolazioni batteriche benefiche, come Bacteroides fragilis, Faecalibacterium prausnitzii e Roseburia e un aumento di specie proinfiammatorie, come Escherichia coli e altre Enterobacteriaceae".
Studi recenti indicano che la modifica del microbioma con i probiotici può offrire un approccio promettente per ridurre i sintomi della fatica
Inoltre "diete ad alto contenuto di antiossidanti e micronutrienti potrebbero contrastare lo stato pro-infiammatorio e migliorare la fatica"
Aggiornamento 29/12/2018
Frutta e verdura sono alimenti che proteggono dalle IBD (morbo di Crohn e colite ulcerosa), mentre grassi animali, omega 6, grassi trans e zuccheri aumentano il rischio. Anche i cibi contenenti cistina (aminoacido solforato) possono creare problemi. Tra i nutrienti, lo zinco e gli omega 3 appaiono protettivi. L'integrità della barriera intestinale e il microbiota hanno un ruolo fondamentale. Tra le diete utilizzabili, dieta FODMAP, SCD (carboidrati specifici), paleodieta hanno diverso grado di evidenza e di efficacia, ma la personalizzazione appare il migliore approccio. Le integrazioni di omega 3, curcumina e vitamina D possono dare sollievo ma hanno effetto soggettivo. Emulsionanti come carbossimetilcellulosa e polisorbato 80, presenti anche in integratori per bambini, possono promuovere la colite, e in generale evitare alimenti industriali sembra la strategia migliore.
Probiotici, cannabis e alcune erbe possono aiutare.
Aggiornamento 4/1/2019
La transglutaminasi microbica (mTg) è un enzima di origine batterica utilizzato nei prodotti da forno (ma anche carni lavorate e latticini) per favorire la coagulazione delle proteine, quindi è usato per migliorare la consistenza del cibo, la gradevolezza e la durata. La sua presenza non deve essere indicata in etichetta.
Gli studiosi hanno scoperto che può indurre permeabilità intestinale, una condizione alla base di molte malattie moderne come diabete e malattie autoimmuni.
Inoltre può modificare i peptidi di gliadina (glutine) alterandone la struttura e formando una sorta di "rete", inducendo così una perdita di tolleranza per questa proteina
"Ci sono notizie allarmanti per il pubblico sul potenziale pericolo di usare o consumare questo enzima. Pubblicazioni recenti hanno dimostrato che mTg è immunogenica nei pazienti con celiachia e la sua patogenicità viene continuamente evidenziata. La base teorica perché mTg sia un nuovo fattore ambientale nell'induzione della celiachia esiste, tuttavia, la causalità dovrebbe essere ulteriormente esplorata".
Aggiornamento 15/1/2019
Le interazioni tra cibo e microbi intestinali in una review.
Butirrato e propionato prodotti dai batteri sono in grado di influenzare la differenziazione delle cellule T nascenti in Tregs, queste ultime svolgono un ruolo vitale nel controllo dell'omeostasi intestinale, prevenendo la permeabilità intestinale e riducendo l'autoimmunità.
Il propionato aumenta anche l'assorbimento di ferro e può prevenire l'anemia.
La metabolizzazione del triptofano è particolarmente importante.
La risposta antiossidante dell'organismo dipende dai nostri batteri, che li trasformano rendendoli più o meno "efficaci"
Aggiornamento 18/1/2019
Secondo una revisione degli studi effettuata da ricercatori del S. Raffaele, i probiotici L. acidophilus,
L. ingluviei, L. fermentum e L. delbrueckii sono associati con aumento di peso, mentre L. gasseri insieme a prebiotici come inulina e galattomannano ha effetto dimagrante e antiinfiammatorio
Aggiornamento 19/1/2019
Nel modello animale, alcuni emulsionanti come il polisorbato80 e la carbossimetilcellulosa, presenti anche negli integratori per bambini, alterano l'asse intestino-cervello, modificando i microbi intestinali e inducendo infiammazione di basso grado. Nei maschi l'esposizione si manifesta come ansia, nelle femmine come ridotta socialità.
Il trapianto di feci è efficace nel breve termine nella colite ulcerosa. Dopo 8 settimane un terzo delle persone va in remissione. Va verificata la sicurezza e l'efficacia nel lungo termine.
Se avete qualche amico con una buona 💩💩 tenetevelo stretto
Aggiornamento 31/1/2019
I lattobacilli promuovono l'integrità della barriera intestinale tramite un recettore chiamato "mincle"
Aggiornamento 3/2/2019
Che rapporto c'è tra batteri intestinali (e non solo) e chi li ospita?
Il microbioma testa e "allena" il sistema immunitario, mentre il sistema immunitario tiene sotto controllo il microbioma.
La "Disbiosi" (alterazione del microbiota) - è associata a malattie autoimmuni come l'artrite reumatoide, la sclerosi multipla (SM) e la celiachia. Non è chiaro se la disbiosi sia un sintomo o una causa della malattia, ma una ricerca ha dimostrato che un tipo di batterio nativo del microbioma, noto come Prevotella histicola, potrebbe essere una chiave per riportarlo "in carreggiata" e alleviare alcuni degli effetti di queste malattie autoimmuni.
Il responsabile della ricerca ha soprannominato questo batterio "brug", unendo le parole bug (microbo) e drug (farmaco).
L'incidenza delle malattie autoimmuni è in aumento nei paesi sviluppati, e non si sa perché. Potrebbe essere dovuto all'"ipotesi dell'igiene", poiché l'ambiente in cui si vive viene pulito eccessivamente, e mentre le persone compiono sforzi maggiori per lavare via o uccidere i batteri, il loro sistema immunitario ha meno esposizione ai microbi e meno "lavoro da fare".
"Un sistema immunitario "ozioso" può diventare un sistema immunitario che sbaglia", afferma il dottor Murray. "Stimolano il nostro sistema immunitario un po 'in modo da mantenere buone difese, ma ci aiutano anche a contenere o controllare quelle risposte immunitarie."
Veena Taneja, una ricercatrice indiana, è stata anche colpita dal fatto che molti pazienti hanno riferito una riacutizzazione dell'artrite reumatoide dopo aver mangiato fagioli. Per essere chiari: i fagioli sono ricchi di proteine e fitonutrienti. Ma le persone possono rispondere in modo diverso a cibi diversi, anche sani..
"Era sempre in fondo alla mia mente: come potrebbero i fagioli reni portare ai dolori?" Dice. "In qualche modo, c'è qualche connessione con l'intestino." Ora è noto che la dieta ha un forte impatto sui microbi intestinali.
Inoltre prendendo topi predisposti all'artrite reumatoide, quelli trattati con P. histicola hanno mostrato "incidenza e gravità dell'artrite significativamente diminuita rispetto ai controlli".
P. histicola ha inoltre mostrato una capacità simile di smorzare la risposta immunitaria del corpo e ridurre i sintomi e la progressione della SM, e anche in questo caso riducendo la flora che rilascia molecole infiammatorie e la permeabilità intestinale.
I ricercatori concludono affermando che se le scoperte si dimostreranno valide anche nell'uomo avremo un'arma in più per queste malattie, e raccomandano di non usare antibiotici se non strettamente necessario.
Aggiornamento 8/2/2019
Una posizione ufficiale della Società europea di Allergologia (EAACI) chiarisce il legame tra microbi, tumori e allergie.
L'ipotesi della biodiversità è una pietra miliare nella comprensione dell'epidemie di malattie allergiche. Una scarsa varietà dei batteri, intestinali e non, aumenta il rischio di allergie.
I bambini ad alto rischio di asma, dermatite atopica e allergie hanno spesso nel loro intestino ridotta abbondanza di Bifidobacterium, Akkermansia, Faecalibacterium e Lactobacilli e maggiore abbondanza dei funghi Candida e Rhodotorula.
I batteri intestinali hanno una forte influenza sugli eosinofili, i globuli bianchi maggiormente coinvolti nelle allergie, nelle infezioni dei vermi e di C. difficile. L. fermentum e L. rhamnosus riducono le allergie agendo sugli eosinofili.
L. rhamnosus induce anche la tolleranza orale nelle allergie alimentari.
Le Tregs sono cellule modulatrici del sistema immunitario, e spesso nell'autoimmunità sono carenti. Bifidobacterium longum 35624, Clostridia e Bacterioides fragilis le aumentano.
Lo stile di vita occidentale, con un eccesso di igiene e cibi che non favoriscono la crescita dei batteri buoni, aumenta anche il rischio di tumori, come la leucemia e il tumore al colon, grazie al batterio Fusobacterium nucleatum.
La permeabilità dei tessuti gioca un ruolo fondamentale in queste malattie: in determinate condizioni, la normale barriera epiteliale dell'intestino può diventare permeabile, permettendo il passaggio di microbi e molecole microbiche nella circolazione sistemica (situazione nota come traslocazione microbica).
Potrebbe pertanto essere possibile ridurre il rischio riducendo la traslocazione microbica attraverso l'uso selettivo dei probiotici.
Aggiornamento 15/2/2019
La celiachia cambia per sempre il sistema immunitario: le cellule T riparatrici sono permanentemente sostituite con cellule T infiammatorie.
"Il nostro nuovo studio suggerisce che anche se i sintomi a breve termine, come la diarrea e il dolore addominale, possono essere alleviati rimuovendo il glutine dalla dieta, le implicazioni a lungo termine possono rimanere", e questo potrebbe essere vero anche nelle altre malattie infiammatorie intestinali.
Aggiornamento 18/2/2019
Un'ipotesi per spiegare la crescente prevalenza di allergie alimentari e non sono le pratiche di vita moderne, tra cui l'abuso di antibiotici, i cambiamenti nella dieta e i tassi più alti di parto cesareo, l'alimentazione artificiale. Queste pratiche alterano le comunità batteriche intestinali; le alterazioni della prima infanzia possono essere particolarmente dannose.
Anaerostipes caccae è un clostridio che vive nell'intestino dei topi che non soffrono di allergie, e "appare utile per la regolazione delle risposte allergiche agli antigeni alimentari, suggerendo che gli interventi che modulano le comunità batteriche possono essere terapeuticamente rilevanti per l'allergia alimentare".
Aggiornamento 21/2/2019
Il sale da cucina (cloruro di sodio) sembra avere inaspettate conseguenze nelle allergie.
Agisce aumentando l'aggressività delle cellule TH2, quelle tipiche della reazione allergica (atopia), attivando alcuni fattori di trascrizione.
La pelle delle persone con dermatite atopica ha maggiori quantità di sodio del normale, e questo aumenta la risposta allergica e favorisce la crescita di Staphylococcus aureus, batterio tipicamente collegato con la dermatite
Aggiornamento 1/3/2019
Avere una sovracrescita intestinale di Candida può peggiorare malattie respiratorie come asma e broncopneumopatia (BPCO) tramite crossreazione con un altro fungo (Aspergillus)
Aggiornamento 2/3/2019
Esistono legami tra funzione immunitaria e intestinale nell'autismo.
"Alterata funzione immunitaria e digestiva, alti livelli di peptidi alimentari circolanti (dovuti alla permeabilità intestinale), presenza di autoanticorpi che interagiscono con proteine alimentari, aumento dei livelli dei metaboliti putrefattivi con potenti azioni sull'intestino e sul comportamento e pattern microbici associati allo spettro autistico (ASD), come alta prevalenza di clostridi e alti rapporti tra Firmicutes e Bacteroidetes, suggeriscono che la disbiosi microbica legata alle proteine aggrava i sintomi sia gastrointestinali che comportamentali".
Aggiornamento 6/3/2019
La Malassezia, un fungo che spesso si ritrova in chi soffre di dermatite seborroica (forfora) e pelle grassa, sembra implicata nella patogenesi del morbo di Crohn
Aggiornamento 9/3/2019
L'uso dei probiotici nelle allergie
Aggiornamento 14/3/2019
Nelle persone con rettocolite ulcerosa, il consumo di frutta migliora il microbiota intestinale e riduce l'infiammazione, abbassando il rischio di complicazioni come la pouchite.
Aggiornamento 23/3/2019
L'uso di antibiotici nel primo anni di vita sembra aumentare (del 26%) il rischio di celiachia. Lo studio è osservazionale quindi non può stabilire un legame causa-effetto, ma esiste una forte plausibilità biologica visto i legami tra celiachia e alterazione del microbiota.
L'invito è quindi ad un uso ragionato degli antibiotici e al reintegro della flora intestinale tramite probiotici
Aggiornamento 28/3/2019
Un probiotico con 8 ceppi somministrato per 6 mesi ha dato risultati incredibili in persone con diabete: diminuzione dei livelli circolanti di endotossine di quasi il 70%, glicemia (38%), insulina (38%), HOMA-IR (64%), trigliceridi (48%), colesterolo totale (19%), rapporto colesterolo totale / HDL (19%), TNF-α (67%), IL-6 (77%), CRP (53%), resistina (53%) e un significativo aumento di adiponectina (72%). Tutto questo senza cambiamenti nella dieta.
Aggiornamento 29/3/2019
Come i batteri interagiscono col metabolismo energetico, grazie all'immunometabolismo: L. gasseri e rhamnosus con B. lactis aiutano a dimagrire
Aggiornamento 11/4/2019
Dopo 2 anni dal trapianto fecale, 12 bambini autistici su 18 hanno avuto miglioramenti nel comportamento e nei sintomi gastrointestinali. Questi bambini hanno spesso ridotta diversità batterica.
Aggiornamento 12/4/2019
I topi sottoposti a terapia antibiotica non rispondono al freddo producendo calore come quelli normali (con la trasformazione degli adipociti bianchi in beige, quelli capaci di termogenesi). "Un microbiota intatto può quindi essere una componente essenziale della risposta termoregolatoria e la funzione appare essere mediata almeno parzialmente dal butirrato derivato da microbi".
Aggiornamento 22/4/2019
Tra le persone con schizofrenia, circa un terzo ha anticorpi IgG antigliadina (contro il glutine, ma diversi da quelli legati alla celiachia). In questo sottogruppo togliere il glutine sembra associato a miglioramento dei sintomi negativi (anedonia, insensibilità, alogia e apatia) ma non della depressione.
I pazienti nel gruppo gluten-free hanno riportato anche meno dolore addominale, diarrea, stitichezza, reflusso e indigestione.
Aggiornamento 25/4/2019
Il propionato è un acido grasso a catena corta prodotto anche dalla flora intestinale e in alcuni studi ha dimostrato di essere antipertensivo e antinfiammatorio. Attualmente è utilizzato come additivo nei prodotti da forno, perché previene la formazione di muffa. Nuovi studi su topi e uomini mostrano che, alle quantità di esposizione comuni, il propionato stimola l'iperglicemia e l'insulinoresistenza, attraverso il sistema nervoso simpatico, e favorisce un lento accumulo di grasso.
Aggiornamento 30/4/2019
Aggiornamento 2/5/2019
Aggiornamento 3/5/2019
Aggiornamento 5/5/2019
La CFS, sindrome da fatica cronica, sembra associata con alcune infezioni come EBV (mononucleosi), virus erpetici ed enterici, metalli pesanti come nichel, cadmio e mercurio, alterazione del microbiota.
Questo porta ad alterazioni del sistema immunitario e stress ossidativo.
Dal punto di vista alimentare è possibile migliorare le condizioni lavorando sulla funzionalità mitocondriale e antiossidante, bilanciando l'azione del sistema immunitario.
Le carenze spesso riscontrate sono vitamina C, complesso vitaminico B, sodio, magnesio, zinco, folati, carnitina, triptofano, acidi grassi essenziali e coenzima Q10.
Aggiornamento 8/5/2019
I probiotici, in particolare quelli contenenti bifidobatteri, sono efficaci nell'indurre remissione nei confronti della colite ulcerosa secondo una revisione sistematica dei dati
Aggiornamento 16/5/2019
I fattori che nei primi mesi di vita influenzano il rischio di asma e allergie
Protettivi: diversità batterica e le specie nel rettangolo verde, tra cui lattobacilli e bifidobatteri, parto naturale e in casa, frequenza dell'asilo nido, presenza di fratelli e animali in casa, contatto con animali da fattoria.
In gravidanza, dieta con alto contenuto di fibre e contatto con animali.
I fattori predisponenti invece sono antibiotici, parto cesareo e prematurità, ridotta diversità batterica ed eccesso di C. difficile e Veillonella.
Aggiornamento 19/5/2019
L'EAACI, la società europea di allergologia, ha rilasciato una posizione sulla funzione dei grassi in relazione ad allergie, dermatite atopica e asma.
I polimorfismi nei geni (le diverse forme genetiche che ognuno di noi porta) associati alla sintesi, catabolismo e utilizzo dei grassi influenzano i loro fabbisogni e funzioni.
Gli omega 3 sono solitamente benefici, mentre gli omega 6 sono metabolizzati a composti proinfiammatori, ma comunque necessari.
È probabile che un approccio nutrizionale personalizzato, compresa la supplementazione di acidi grassi, sia necessario per osservare i benefici ottimali che possono venire dagli acidi grassi nella prevenzione e nel trattamento delle allergie e dell'asma.
La supplementazione con omega 3 o il consumo di alimenti ricchi di questi grassi (ad esempio, pesce grasso, alcune microalghe e carne di ruminanti allevati con un adeguato esercizio fisico e una dieta a base di erbe) sono probabilmente utili.
Si ribadisce la nocività dei grassi trans, a parte il CLA presente nei prodotti caseari.
Anche il microbiota interagisce, in particolare con la produzione di grassi a catena corta (SCFA).
Aggiornamento 24/5/2019
Curare l'intestino e i suoi batteri è un modo efficace, insieme ai farmaci, per alleviare l'ansia. Questo il risultato di una revisione degli studi. Sia i probiotici che le diete sono efficaci, ma queste ultime di più. I ricercatori concludono che "soprattutto per i pazienti con malattie somatiche che non sono adatti per l'applicazione di farmaci psichiatrici per il trattamento dell'ansia, l'uso di probiotici e/o altri metodi come la dieta LowFODMAP possono essere applicati in modo flessibile a seconda delle condizioni cliniche".
Aggiornamento 26/5/2019
Segnalo un buon articolo sulla tolleranza orale scritto da una collega, in cui si spiega come deficit ormonali e nutrizionali possano indurre le sensibilità ma se corretti si possa comunque recuperare.Aggiornamento 28/5/2019
Che legame esiste tra pelle e microbi?
I batteri buoni rilasciano dei metaboliti antinfiammatori che modulano il sistema immunitario e possono essere d'aiuto in numerose patologie dermatologiche, come dermatite atopica e da contatto. Lattobacilli e bifidobatteri sembrano i più indicati, e possono essere eventualmente somministrati come probiotici.
I probiotici sono indicati per "decolonizzare" i patogeni della pelle (in particolare P. aeruginosa e S. aureus).
L. rhamnosus e L. reuteri sono particolarmente indicati nella dermatite atopica.
L. casei riduce l'infiammazione dermica abbassando le citochine infiammatorie, mentre E. coli Nissle 1917 riduce il rischio di dermatite da contatto.
B. infantis, col suo effetto antinfiammatorio, è utile generalmente nella psoriasi, L. sporogenes in quella pustolosa.
I lattobacilli riescono inoltre a ridurre l'acne, associata al batterio P. acnes . Anche i prebiotici, le fibre che stimolano la crescita dei batteri, sono utili.
Aggiornamento 29/5/2019
L'influenza degli SCFA prodotti dai batteri nel metabolismo energetico: stimolano il consumo energetico nel muscolo, BAT e WAT
Aggiornamento 4/6/2019
È nota da tempo la relazione tra tolleranza al cibo, allergie e microbiota intestinale. Anche il microbiota cutaneo però può avere un peso. S. aureus è un batterio che quando presente nella pelle in eccesso favorisce l'eczema (dermatite atopica). Ma questa sovracrescita sembra legata anche all'allergia alle arachidi e alla ritardata risoluzione dell'allergia all'uovo.
Aggiornamento 5/6/2019
Esiste una connessione tra intestino e cervello, e questi organi si influenzano a vicenda.
"A causa di questa forte legame cerebrale, lo stress e una varietà di emozioni negative come ansia, tristezza, depressione, paura e rabbia possono influenzare il sistema gastrointestinale (GI). Questi trigger possono accelerare o rallentare i movimenti del tratto gastrointestinale e del contenuto al suo interno; rendere il sistema digestivo eccessivamente sensibile al gonfiore e ad altri segnali di dolore; rendere più facile per i batteri attraversare il rivestimento dell'intestino e attivare il sistema immunitario (permeabilità intestinale); aumentare l'infiammazione nell'intestino; e cambiare il microbiota intestinale (i tipi di batteri che risiedono nell'intestino). Ecco perché lo stress e le forti emozioni possono contribuire a influenzare o peggiorare una varietà di condizioni gastrointestinali come la malattia infiammatoria dell'intestino (morbo di Crohn e colite ulcerosa), la sindrome dell'intestino irritabile (IBS), la malattia da reflusso gastroesofageo (GERD) e le allergie e sensibilità alimentari.
I cambiamenti negativi nel sistema GI possono quindi influenzare il cervello, creando un circolo vizioso. Ad esempio, una nuova ricerca sta dimostrando che l'aumento dell'infiammazione intestinale e i cambiamenti nel microbioma intestinale possono avere effetti profondi in tutto il corpo e contribuire alla fatica cronica, alle malattie cardiovascolari e alla depressione.
Abbiamo anche imparato che determinati tipi di alimenti possono scatenare reazioni specifiche nell'intestino di individui sensibili. In questi casi, diete specifiche, come la FODMAP o evitare certi cibi per il GERD, possono essere utili per la gestione dei sintomi. La dieta influenza anche profondamente il microbioma intestinale. Ad esempio, mangiare una dieta più vegetale con pochi carboidrati raffinati e poca o nessuna carne rossa porta spesso a un microbioma più sano. Questi cambiamenti nella dieta a loro volta riducono l'infiammazione intestinale e possono aiutare a ridurre sintomi sistemici come affaticamento o depressione e il rischio di malattie cardiovascolari.
Sebbene la situazione di ciascuna persona sia unica, si può trovare spesso che una combinazione di approcci integrativi può essere utile per ridurre i sintomi della GI e ristabilire sia un intestino sano che una mente sana".
Aggiornamento 12/6/2019
Un articolo sul legame tra microbiota e allergie alimentari.
Aggiornamento 13/6/2019
Uno studio compiuto su migliaia di gemelli dimostra che le linee guida dietetiche classiche e uguali per tutti siano troppo semplicistiche e che un approccio personalizzato alla nutrizione possa fornire migliori benefici a lungo termine per la salute.
I ricercatori hanno misurato i livelli ematici di zucchero, insulina e lipidi in risposta a pasti specifici, incrociandoli con i dati su attività, sonno, fame e batteri intestinali (microbioma) in migliaia di partecipanti negli Stati Uniti e nel Regno Unito, per lo più coppie di gemelli.
"I risultati rivelano un'ampia variazione nelle risposte del sangue agli stessi pasti nelle diverse persone, sia che contenessero carboidrati o grassi.
Ad esempio, alcuni partecipanti hanno avuto aumenti rapidi e prolungati della glicemia e dell'insulina, che sono legati all'aumento di peso e al diabete. Altri avevano livelli di grasso che hanno raggiunto il picco e persistevano nel flusso sanguigno ore dopo un pasto, aumentando il rischio di sviluppare malattie cardiache.
Questa risposta era dovuta solo parzialmente a motivi genetici, visto che cambiava anche tra gemelli. La variabilità era quindi attribuibile anche al microbiota.
Sorprendentemente, le proporzioni di nutrienti come grassi, proteine e carboidrati elencati nelle etichette degli alimenti spiegano meno del 40% delle differenze tra le risposte nutrizionali degli individui ai pasti con quantità simili di calorie. Ci sono anche grandi differenze nelle risposte agli stessi pasti a seconda dell'ora del giorno in cui vengono mangiati.
I risultati suggeriscono che le differenze personali nel metabolismo dovute a fattori come il microbioma intestinale, la tempistica dei pasti e l'esercizio fisico sono importanti quanto la composizione nutrizionale degli alimenti, sostenendo l'idea che la semplice etichettatura nutrizionale è insufficiente per valutare il cibo".
È stato così messo a punto un algoritmo (dalla società ZOE) che può prevedere in base ai parametri personali quale sia l'alimentazione più appropriata
Il dott. Andrew Chan, professore di medicina presso la Harvard Medical School e gastroenterologo del Massachusetts General Hospital, ha dichiarato: "È rassicurante che il nostro corredo genetico spieghi solo parzialmente come il nostro organismo risponde al cibo, sottolineando che il nostro metabolismo non è fisso - abbiamo il potere di cambiarlo. Una strada eccitante è quella di adattare le nostre diete ai batteri nel nostro intestino che ci aiuta a metabolizzare i nutrienti ".
"Per la maggior parte di noi, il cibo che mangiamo è la medicina più importante che prendiamo, eppure siamo tutti profondamente confusi su ciò che è buono per noi. Crediamo che unire scienza e intelligenza artificiale possa aiutarci, comprendendo per la prima volta le nostre risposte individuali al cibo ", ha detto il co-fondatore e CEO di ZOE, Jonathan Wolf.
Aggiornamento 17/6/2019
Sappiamo da tempo (va be', chi studia) che c'è uno stretto legame tra autoimmunità e microbiota, perché i batteri e i loro metaboliti hanno forte influenza sul sistema immunitario.
Tra i meccanismi, la disbiosi (alterazione qualitativa della flora) che riduce i T-reg e aumenta i Th-17, portando ad uno squilibrio tra i globuli bianchi e perdita della tolleranza immunologica; la formazione di antigeni, dovuta agli enzimi proteolitici dei batteri, che "tagliano" le proteine dell'ospite formando proteine riconosciute come "estranee" dal sistema immunitario; mimetismo molecolare, somiglianza di alcune proteine batteriche con quelle delle nostre strutture, che creano lo stimolo immunitario che spinge i nostri globuli bianchi ad attaccare le proteine del proprio corpo; traslocazione batterica, ossia componenti/metaboliti microbici traslocano (tramite permeabilità intestinale) nel sistema circolatorio e vengono trasportati a organi e tessuti specifici, provocando lesioni immunopatologiche.
I probiotici possono aiutare ma spesso l'intervento da effettuare è più complesso a causa delle interazioni a livello epigenetico (espressione di geni) col sistema immunitario.
Aggiornamento 19/6/2019
Un comune batterio intestinale, Roseburia intestinalis, potrebbe essere tra i responsabili in persone predisposte geneticamente della sindrome anticorpi antifosfolipidi, una malattia autoimmune che dà problemi di coagulazione e trombosi
Aggiornamento 22/6/2019
Un modello animale mette in relazione alcuni cibi confezionati con il rischio di autismo.
Infatti assumere acido propionico in gravidanza crea gliosi, un'alterata proliferazione delle cellule nervose, con conseguente infiammazione cerebrale e rischio di alterare la normale architettura nervosa.
L'acido propionico (o propionato, E280 o E289) è contenuto come conservante nel pane industriale e in generale nei prodotti da forno e frutta conservata, si forma nel formaggio ed è prodotto da alcuni batteri intestinali. Alcuni studi mostrano come un microbiota produttore di propionato peggiori la neuroinfiammazione dei bambini autistici.
Aggiornamento 25/6/2019
Alcuni Clostridi e Bacteroidi proteggono dalle allergie e possono essere anche terapeutici
Aggiornamento 30/6/2019
Le persone con allergie hanno spesso disbiosi intestinale.
Il trattamento con alcuni batteri della classe Clostridia (Bacteroides fragilis, Bacteroides ovatus, Bacteroides vulgatus, Prevotella melaninogenica e Parabacteroides distasonis) previene le allergie alimentari nei topi geneticamente predisposti
Aggiornamento 1/7/2019
Che legame esiste tra microbi intestinali e tiroide?
È probabile un contributo del microbiota nell'autoimmunità tiroidea.
A causa del mimetismo molecolare, specie normalmente ritenute benefiche come Lactobacilli e Bifidobatteri possono indurre anticorpi che determinano una reazione incrociata con la tireoperossidasi e la tireoglobulina (le proteine coinvolte nella tiroidite di Hashimoto, HT).
I pazienti con Basedow o HT producono anticorpi anti-gliadina, anti-transglutaminasi e anti-lievito (Saccharomyces cerevisiae). Gli studi sull'uomo hanno riportato una maggiore abbondanza di Prevotellaceae e Pasteurellaceae nei malati, mentre Enterobacteriaceae, Veillonellaceae e Rikenellaceae erano significativamente più bassi rispetto ai controlli sani. Rispetto ai controlli sani, negli ipertiroidei sono stati riportati una diminuzione di Bifidobacteria e Lactobacillaceae e un aumento di Enterococchi.
La supplementazione con Lactobacillus reuteri ha migliorato la funzionalità tiroidea nei topi aumentando la tiroxina libera (T4), la massa tiroidea e i parametri fisiologici come il peso e la struttura della pelle.
Il microbiota inoltre influenza il metabolismo dei farmaci per la tiroide. L'efficacia della supplementazione orale di L-tiroxina attraverso il suo assorbimento nello stomaco, nel duodeno e nel digiuno da parte di diversi trasportatori può dipendere dalla misura in cui il microbiota degrada gli ormoni tiroidei tramite ossidazione. In caso di proliferazione batterica (SIBO) potrebbe essere necessario dare dosi più elevate di L-tiroxina. Nell'ipotiroidismo, dove il pH dello stomaco aumenta spesso e la motilità gastrica diminuisce, può verificarsi una riduzione della proteolisi nello stomaco e una crescita batterica eccessiva. Anche l'infezione da H. pylori può alterare il metabolismo della L-tiroxina.
Il microbiota influenza anche l'assorbimento dello iodio necessario per sintetizzare gli ormoni tiroidei.
I sali biliari influenzano il metabolismo tiroideo e il TSH, e vengono metabolizzati da diverse specie, soprattutto Clostridi.
Il selenio, un minerale importante per la tiroide, aumenta la quantità di Bacteroidetes e Bifidi.
L'uso di probiotici può facilitare l'assestamento della terapia per ipotiroidismo, ma per ora non sono indicati come terapia, il loro uso rimane solo potenziale.
Aggiornamento 3/7/2019
Tra le proteine del grano che possono creare problemi, oltre al citatissimo glutine, vi sono gli inibitori della amiliasi-tripsina (ATI). Il nostro corpo non si è evoluto per degradare queste proteine, ma l'hanno fatto i nostri batteri. Quando l'uomo è passato da un'alimentazione da cacciatore-raccoglitore a quella da agricoltore, si è arricchito di bifidobatteri e lattobacilli. E proprio questi ultimi degradano le ATI. Se non digerite bene può essere un problema di disbiosi, molto comune a causa della scarsa introduzione di fibra e dell'uso di farmaci spesso troppo disinvolto.
Aggiornamento 5/7/2019
Alcuni medici pensano che la CFS non esista perché non riscontrano cambiamenti negli esami che conoscono. Ma la malattia è evidenziabile dalla neuroinfiammazione e dai cambiamenti nel metabolismo energetico, che non riesce a trarre energia dai substrati come carboidrati, proteine e grassi.
In altre parole, l'organismo umano manca di "energia" perché le sue cellule hanno un problema a generare (e possibilmente usare) energia. Inoltre, molti studi hanno riportato marcatori sia dello stress ossidativo che dello stress nitrosativo (ad es. Livelli aumentati di un enzima che produce ossido nitrico).
La neuroinfiammazione potrebbe avere diversi "attivatori" in individui diversi. In alcuni casi, potrebbe essere indotto da infezioni cerebrali (come l'infezione da herpesvirus cronica), autoanticorpi, neurotossine o stress cronico. In altri casi, l'infiammazione al di fuori del cervello può attivare il sistema immunitario innato all'interno del cervello, sia attraverso i segnali umorali che infrangono la barriera ematoencefalica che diventa permeabile sia attraverso segnali retrogradi inviati sul nervo vago. Sono state portate recentemente diverse prove che l'infiammazione intestinale può essere un fattore scatenante periferico della neuroinfiammazione: il microbiota intestinale dei pazienti con CFS spesso include un numero elevato di specie proinfiammatorie e un basso numero di specie antiinfiammatorie.
Lo stato relativamente ipometabolico osservato nei pazienti con CFS potrebbe anche riflettere un'antica risposta biologica correlata a danni o lesioni.
Aggiornamento 11/7/2019
Una dieta ricca in fibre può aiutare a prevenire la preeclampsia, un disordine della gravidanza.
Infatti le fibre vengono trasformate dai batteri in SCFA e in particolare acetato, che modula il sistema immunitario, e questo riduce il rischio della malattia. I bambini nati da mamma con preeclampsia hanno aumentato rischio di malattie autoimmuni e allergie.
Aggiornamento 13/7/2019
Può il sale agire da antigene? In un certo senso sì, perché capace di attivare molti tipi di cellule immunitarie. Inoltre aumenta la produzione di un composto (IsoLG) che stimola le cellule dendritiche.
In ultimo determina disbiosi, con aumento dei Firmicutes e riduzione dei Bacteroidetes.
Tutto questo porta ad uno stato di infiammazione e predispone per l'ipertensione, il principale fattore di rischio cardiovascolare.
Finalmente alcuni scienziati si sono presi la briga di fare una revisione sulla permeabilità intestinale (IP), una proprietà fisiopatologica del tratto digerente che può essere correlata con malattie.
"Riscontrandosi in numerose patologie croniche, può essere considerata una caratteristica della malattia cronica piuttosto che un semplice problema di salute digestiva.
Elevati livelli di marcatori proinfiammatori, dislipidemia, iperglicemia, tendenza all'obesità, malattie croniche avanzate e consumo di una dieta di tipo occidentale sono stati identificati come i più forti fattori di rischio per alterata IP".
"Il coinvolgimento dell'IP nelle malattie croniche, mette in evidenza la potenziale importanza dell'integrità intestinale nella salute e nella malattia. Vi è probabilmente un effetto sinergico tra i fattori di rischio. In particolare, il BMI, l'età, il consumo di alcol e l'infiammazione sono stati tutti identificati come aventi un certo grado di effetto sinergico; sebbene, l'infiammazione sembra essere il fattore principale".
Sull'alimentazione i dati sono limitati, ma alcol, junk food, eccesso proteico favoriscono la condizione, mentre le fibre sono protettive.
Tra i test per verificare la condizione, zonulina e assorbimento degli zuccheri.
L'IP spesso si abbina a sensibilità alimentari e intolleranza all'istamina, rendendo più complicato il quadro, che comunque un bravo professionista della salute può essere in grado di risolvere.
Aggiornamento 24/7/2019
I batteri regolano il rapporto tra Treg e Th17 e di conseguenza l'infiammazione.
Aggiornamento 27/7/2019
Una flora intestinale sbilanciata produce 12,13-diHOME. Questo composto riduce il numero di T-reg, i globuli bianchi che inducono la tolleranza verso alimenti e antigeni. Più aumenta 12,13-diHOME, più aumenta il rischio di allergie. Ecco perché allattamento, alimentazione e probiotici sono una risorsa nel prevenire e gestire le allergie e l'asma.
Aggiornamento 1/8/2019
Ieri a SuperquarkRai è stato detto che le arachidi non vanno introdotte prima dell'anno di età. Questo non corrisponde alle ultime conoscenze e linee guida, secondo cui vanno introdotte precocemente (4-6 mesi,contestualmente al normale svezzamento), soprattutto in bambini ad alto rischio (che presentano eczema per esempio). Sappiamo oggi che ritardare l'introduzione aumenta il rischio di allergia
Aggiornamento 3/8/2019
Chi assume antiacidi ha necessità mediamente del doppio dei farmaci per le allergie. Questo dipende probabilmente dalla mancanza di acidità gastrica che riduce la digestione delle proteine e le rende più allergeniche. Insomma viene favorito lo sviluppo di allergie.
Aggiornamento 5/8/2019
Il legame tra immunità e peso corporeo, al di là delle calorie.
Aggiornamento 6/8/2019
Negli adolescenti, la severità della depressione è proporzionale alla permeabilità intestinale. Questo avviene tramite la stimolazione del sistema immunitario, che altera il sistema nervoso predisponendo alla malattia.
Aggiornamento 7/8/2019
Il kefir è un alimento ricco di batteri potenzialmente benefici per l'intestino e la salute cardiovascolare. I batteri interagiscono però col sistema immunitario e in persone con alterazioni possono non dare un risultato positivo.
Aggiornamento 9/8/2019
In soli 7 giorni, la supplementazione con inulina porta a un miglioramento dell'asma, anche più dei cortisonici. Questo avviene mediante variazione del microbiota
"... L'integrazione di fibre solubili modula il microbioma intestinale e l'analisi post-hoc ha identificato le azioni anti-infiammatorie nelle vie aeree, che potrebbero fornire un'opzione non farmacologica alla gestione dell'asma."
Aggiornamento 13/8/2019
Il microbiota modula la reazione allergica e i probiotici possono aiutare.
Aggiornamento 23/8/2019
La permeabilità intestinale aumenta con l'avanzare della gravidanza nelle donne sovrappeso e obese. Omega 3 e probiotici non sono stati in grado di ridurla.
Aggiornamento 24/8/2019
La rivista Nutrients pubblica le relazioni tra IgG e cibo sostenute dal dott. Speciani e colleghi
Probiotici e trapianto fecale nella modulazione del sistema immunitario
Aggiornamento 25/8/2019
Il nervo vago è un'interfaccia tra intestino, microbiota e cervello. Una riduzione del tono vagale è presente nelle persone con IBD e IBS. Nel modello animale L. johnsonii aumenta il tono
Aggiornamento 27/8/2019
La fermentazione con lievito madre riduce l'indice glicemico, il contenuto di glutine, migliora la disponibilità di minerali e la digeribilità per persone con IBS (colon irritabile)
Aggiornamento 30/8/2019
Rielaborare il microbiota con dieta e integrazione riduce il colesterolo e l'aterosclerosi, sopprime la produzione dei messaggeri infiammatori, migliora l'integrità della barriera intestinale, ribilancia acidi grassi e sali biliari in maniera positiva
Aggiornamento 31/8/2019
Sebbene l'uso sia solo promettente al momento, esistono le basi per utilizzare i prebiotici per bilanciare la flora in modo da migliorare sintomi allergici cutanei, alimentari e respiratori. La miglior "finestra d'opportunità" per la prevenzione appare essere la gravidanza, mentre la somministrazione nei neonati ha dato risultati limitati.
Aggiornamento 3/9/2019
Un particolare ceppo di L. gasseri, classificato OLL2716 (o LG21), agisce nello stomaco e non nell'intestino, migliorando la dispepsia funzionale, la disbiosi gastrica e rimettendo al suo posto H. pylori (HP), responsabile spesso dei problemi gastrici come il reflusso. In particolare vengono ridotti i Proteobacteria (come E. coli e HP), alcuni dei quali rilasciano LPS, una componente infiammatoria presente oltre che nei problemi gastrici anche nel diabete, soprattutto in caso di permeabilità intestinale
Aggiornamento 14/9/2019
Qual è l'evidenza sull'uso di diete restrittive nei bambini con ADHD e autismo?
La dieta senza glutine e caseine può essere benefica nei bambini con autismo e problemi gastrointestinali, ma ci sono poche evidenze per raccomandarla a tutti. Se si utilizza si devono quindi informare le persone sul rapporto rischi/benefici.
Anche l'esclusione degli additivi alimentari nei bambini con ADHD non ha mostrato forti evidenze, ma in generale sono sostanze non necessarie quindi si dovrebbero minimizzare a prescindere.
Alcuni bambini con ADHD rispondono bene a una dieta oligoantigenica, ossia che minimizza gli alimenti allergizzanti che attivano l'iperattività.
"Le nuove ricerche dovrebbero anche includere l'identificazione dei predittori della risposta al trattamento, soprattutto dato che le diete di eliminazione possono migliorare il comportamento solo in un (piccolo) sottogruppo di bambini affetti. La ricerca futura potrebbe anche indirizzare la connessione microbiota - intestino - cervello come un potenziale meccanismo alla base dello sviluppo di disturbi del neurosviluppo e dell'effetto delle diete di eliminazione nel ridurre i sintomi. Un approccio multidisciplinare è essenziale per lo studio della relazione tra la connessione microbiota-intestino-cervello e sintomi comportamentali di autismo e ADHD, che potenzialmente coinvolge più sistemi, tra cui il sistema metabolico, immunitario, endocrino e neurale.
Una delle cause dell'artrite reumatoide è un batterio orale, Porphyromonas Gingivalis, che rilascia fattori che stimolano l'autoimmunità.
Per questo si dovrebbe raccomandare particolare attenzione all'igiene orale in chi è affetto da questa malattia, e per quanto mi riguarda somministrazione di probiotici
Aggiornamento 21/9/2019
In un gruppo di bambini cinesi quelli con asma e rinite avevano meno bifidobatteri ma uguali lattobacilli, suggerendo che la carenza dei primi può portare allo sbilanciamento immunitario responsabile delle allergie.
Aggiornamento 27/9/2019
L'alterazione del microbiota aumenta il rischio di allergie alimentari. Parto cesareo, antibiotici e eccesso di igiene sono fattori importanti. Vari bifidi e lattobacilli possono essere utili nella gestione delle allergie alimentari. I migliori sono forse B. infantis e L. rhamnosus GG.
Aggiornamento 28/9/2019
La permeabilità intestinale alterata è stata osservata nelle malattie intestinali (IBS e IBD), steatoepatite non alcolica (NASH), cirrosi epatica, pancreatite acuta, colangite biliare primaria (PBC), diabete di tipo 1 e di tipo 2, malattia renale cronica, insufficienza cardiaca cronica (CHF), depressione ecc
"L'aumento della permeabilità intestinale è un nuovo obiettivo per la prevenzione e la terapia delle malattie. Considerando la stretta relazione tra "intestino permeabile" e disbiosi intestinale con le principali malattie, possiamo concludere che gli approcci dietetici e probiotici meticolosi per il recupero del microbiota sano hanno il potenziale per la gestione delle malattie connesse".
Aggiornamento 3/10/2019
Tra i possibili fattori che modulano il rischio di diabete di tipo 1, l'eccesso di igiene, alcune infezioni enteriche e da raffreddamento, malattie esantematiche, che spiegano anche la stagionalità della scoperta della malattia, le crossreazioni con gli antigeni alimentari e la permeabilità intestinale. Tra i batteri sembrano più abbondanti i Bacteroidetes e scarsi i produttori di butirrato. Anche viroma e micobioma sono alterati. L'allattamento al seno appare protettivo, soprattutto grazie all'apporto di bifidobatteri come B. infantis.
Tra i fattori nutrizionali, gli omega 3 sono protettivi mentre l'esagerato consumo di latte aumenta il rischio. Anche introdurre il glutine dopo i 9 mesi potrebbe aumentare il rischio, così come lo svezzamento precoce.
Tra le vitamine, la carenza della D aumenta il rischio, mentre vi è incertezza per le altre. Lo zinco potrebbe essere protettivo, mentre nitriti, nitrati e nitrosammine (carni lavorate) devono essere ulteriormente indagate.
Aggiornamento 7/10/2019
L'esposizione ai PCB e altre tossine ambientali crea disbiosi e permeabilità intestinale e può alterare il neurosviluppo e la risposta allo stress grazie alle tossine rilasciate dalle specie patogeniche in eccesso.
Un probiotico che aiuta nella digestione del glutine
Aggiornamento 16/10/2019
Specifici microbi e pattern nutrizionali sono associati a un ridotto rischio di sviluppare allergie e asma
Aggiornamento 21/10/2019
Le ricerche associano gli alimenti industriali, che sono prevalenti nella dieta occidentale, con aumentodipeso, obesità, aumento della resistenza all'insulina e un rischio più elevato di diabete di tipo 2. Anche il rischio di tumori e malattie autoimmuni sale. Tuttavia esistono persone che mangiano cibo-spazzatura in quantità elevate senza avere alcun problema, e
questo potrebbe essere collegato ad alcuni batteri intestinali. Nei topi si
è infatti evidenziato che alcuni batteri sono capaci di degradare composti
potenzialmente tossici come gli AGEs, la fruttosolisina (derivante dalla reazione di Maillard) presente in latte ultra pastorizzato, pasta, cioccolato e cereali, che possono essere tra i colpevoli dell'aumentato
rischio di malattia. Chi
possiede questi batteri probabilmente può preoccuparsi meno della qualità della
sua dieta, anche se a lungo termine non si possono trarre
conclusioni.
Aggiornamento 22/10/2019
Il primo studio in cui le persone con CFS (sindrome da fatica cronica) hanno ricevuto un trapianto fecale ha dato risultati promettenti.
Aggiornamento 23/10/2019
Perché le persone si ammalano di patologie autoimmuni? Una delle (tante) risposte è E. gallinarum, un batterio patobionte (che sta nell'intestino solitamente senza dare problemi), ma che se trasloca nel circolo sanguigno suscita la risposta infiammatoria e autoimmune, aggirando le cellule immunitarie e colonizzando i tessuti. Nel mentre noi abbiamo ancora laureati che sostengono che la permeabilità intestinale non esiste
Aggiornamento 24/10/2019
I mastociti (o mastcellule) sono noti per svolgere un ruolo cruciale nella manifestazione di malattie allergiche e non allergiche. Rilasciano l'istamina, il mediatore dell'allergia. Una dieta ricca in fibre (il contrario della tipica dieta occidentale) porta alla fermentazione da parte dei batteri e alla produzione di butirrato, grasso a catena corta che blocca il rilascio di istamina e inibisce in diverse vie i mastociti. Questo può portare ad un miglioramento di tutte le malattie legate all'istamina, come allergie alimentari, dermatite atopica, IBD, asma.
Aggiornamento 27/10/2019
Il metabolismo del triptofano è pesantemente influenzato dalla qualità della flora intestinale: una buona flora migliora la la produzione di serotonina, una flora alterata aumenta quella di kinurenina. Lactobacillus helveticus e plantarum e Bifidobacterium longum riducono la produzione di kinurenina e aumentano la disponibilità di precursore della serotonina (5-HT) e sono quindi potenzialmente terapeutici per la depressione
Aggiornamento 28/10/2019
Esiste una relazione lineare tra uso di antibiotici nel primo anno di vita e rischio di celiachia. Il legame è probabilmente l'alterazione del microbiota.
Aggiornamento 29/10/2019
I consigli per la reintroduzione degli alimenti dopo diete di eliminazione.
Aggiornamento 1/11/2019
Il viroma può essere più importante del microbiota, perché lo controlla
Aggiornamento 7/11/2019
Il microbiota intestinale, al di là delle calorie, si sta rivelando più importante di quanto ipotizzato nei confronti dell'obesità infantile.
Alimentazione sbagliata (iperproteica o ipercalorica), disbiosi, carenze nutrizionali, uso di antibiotici, parto cesareo, sovrappeso della mamma, uso di latte artificiale sono fattori che aumentano il rischio.
Allattamento prolungato, parto naturale, microbiota bilanciato, uso corretto degli integratori, sono invece fattori protettivi, perché bilanciano il sistema immunitario e l'infiammazione e aumentando il grasso bruno.
Aggiornamento 8/11/2019
L'uso di un simbiotico (probiotico misto + FOS) ha portato in 8 settimane a riduzione del farmaco e miglioramento dei parametri di funzionamento tiroideo in persone con ipotiroidismo
Aggiornamento 13/11/2019
In soli 2 giorni una dieta con alte quantità di zucchero aumenta la suscettibilità alla colite nei topi. Questo avviene alterando il microbiota, promuovendo i batteri patogeni come E. coli, inibendo la produzione di SCFA e aumentando la permeabilità intestinale. Aggiungere acetato riduce la suscettibilità.
Aggiornamento 14/11/2019
Le condizioni di allergia e sensibilità ai lieviti, che esistono nonostante alcuni neghino. Ad esempio l'esclusione dei lieviti ha portato a remissione della idrosadenite suppurativa in 12 persone.
Aggiornamento 17/11/2019
Uno dei miti a cui molti credono, compresi molti professionisti, è che siamo in grado di digerire qualsiasi cosa. Questo avviene solo in persone sane e con un microbiota in ordine. Un bravo professionista sa però che in caso di problemi sistemici si deve partire dall'intestino per risolvere infiammazione e disbiosi. Lo spiega bene nel suo ultimo lavoro il prof Riccio, che mette in relazione cibo non digerito, carenza di nutrienti immunomodulanti e malattie neuroinfiammatorie come sclerosi multipla, SLA, Parkinson, Alzheimer e autismo. Parti di cibo indigerito (soprattutto glutine e latticini), additivi, grassi saturi e trans, alcol, genericamente il cibo industriale sono tutti in grado di indurre una risposta infiammatoria e in persone predisposte sostenere la malattia.
Il probiotico B. infantis migliora lo stato infiammatorio nel modello animale di sindrome di Guillain-Barré, bilanciando il rapporto tra Th1, Th2, Th17 e Tregs.
Aggiornamento 21/11/2019
Aggiornamento 24/11/2019
Mitocondri, antiossidanti e radicali liberi.
"Molte malattie croniche sono causate da un aumento dei livelli intracellulari di radicali liberi ... [e sebbene] i livelli basali delle specie reattive dell'ossigeno (ROS) siano essenziali per i processi fisiologici di base, l'eccessiva generazione di radicali liberi provoca danni ossidativi ai tessuti... Lo stress ossidativo causato da ROS induce disfunzione mitocondriale, stress del reticolo endoplasmatico e stato infiammatorio".
"... La vita in stile occidentale comporta in particolare un aumento dell'assunzione di grassi, con conseguente stress ossidativo e alterato controllo dello stimolo ... [e] i mitocondri sono i siti primari dedicati all'ossidazione dei lipidi, e per questo generano molti ROS...", soprattutto in caso di grassi trans o perossidati come nei prodotti da forno.
“… [Ad esempio] l'accumulo di 4-idrossi-2- esenale (4-HHE)… [un] composto aldeidico estremamente reattivo derivato dall'ossidazione lipidica ... nel [sangue] dopo il consumo di acido grasso polinsaturo omega-3 ossidato provoca stress ossidativo e infiammazione nell'intestino superiore dopo assorbimento intestinale ... "
Lo stress ossidativo è dato anche dall'iperglicemia e dagli acidi grassi liberi rilasciati da fegato e tessuto adiposo.
In generale, la produzione di "radicali liberi è una risposta cellulare vitale allo stress ossidativo, tuttavia un'esposizione eccessiva, ad esempio a causa di scarso controllo dello stress, esposizione ambientale alle tossine o il consumo di una dieta povera può attivare una serie di fattori di trascrizione e indurre disfunzione del tessuto adiposo e nei mitocondri, alla base del potenziale sviluppo della sindrome metabolica '.
Nel lavoro gli autori illustrano diversi polifenoli che possono avere un'applicazione nutraceutica e "possono funzionare come antiossidanti in generale, ma la potenza degli effetti ottenuti attraverso il loro consumo dipenderà in gran parte dalle vostre popolazioni microbiche basali personali".
"In quanto tale, sebbene alcuni polifenoli possano essere di beneficio per alcuni, non tutti riceveranno gli stessi benefici.
Pertanto, sebbene l'aggiunta di alimenti ricchi di antiossidanti in una dieta possa essere un modo per migliorare i livelli di stress ossidativo cellulare e disfunzione dei mitocondri, una maggiore attenzione agli stress ambientali e alla salute intestinale in generale, può ottenere risultati superiori".
Aggiornamento 27/11/2019
Tante malattie partono o sono comunque collegate con l'intestino.
La miocardite è una malattia cardiaca infiammatoria che può evolvere in cardiomiopatia letale, ed esiste un crescente corpus di prove che il microbiota umano sia un modulatore critico delle malattie infiammatorie tra cui la miocardite.
Trapiantare nei topi le feci delle persone con la malattia fa emergere i sintomi negli animali, e nell'uomo la gravità della malattia è proporzionale agli anticorpi verso Bacteroides thetaiotaomicron, un particolare batterio che attiva la risposta immunitaria (CD4) in persone predisposte. "Pertanto, lavorare sul microbiota di pazienti con miocardite geneticamente predisposti o di pazienti sensibili sottoposti a trattamento con immunosoppressori può alleviare la gravità della malattia e può quindi aiutare a prevenire le sequele potenzialmente letali della cardiomiopatia infiammatoria".
Aggiornamento 28/11/2019
La dieta chetogenica è probabilmente l'approccio alimentare più efficace nell'emicrania. In persone con sensibilità alimentari le diete di eliminazione possono funzionare, ma anche la semplice riduzione del sale può essere efficace. Uno dei meccanismi possibili è la riduzione dell'infiammazione grazie al bilanciamento tra omega 6 e omega 3
Aggiornamento 9/12/2019
La candida in collaborazione con H. pylori è una possibile responsabile di problemi allo stomaco (dispepsia), soprattutto se si usano antiacidi che favoriscono la colonizzazione. Se avete problemi digestivi e non si capisce perché potete indagare su una possibile presenza di candida
Aggiornamento 13/12/2019
Il microbiota contribuisce alla nostra salute anche con la produzione di vitamine. Quando si ha carenza di vitamine, anche il metabolismo energetico e l'immunità ne risentono: viene privilegiata la via glicolitica, che sfavorisce l'ossidazione dei grassi, e stimola le cellule immunitarie infiammatorie (Th1, Th2, Th17, macrofagi M1).
Invece le vitamine favoriscono la "polarizzazione" verso cellule immunitarie protettive: i folati sostengono i Treg, La B3 i macrofagi M2 e le cellule dendritiche.
Aggiornamento 28/12/2019
I polifenoli piacciono al microbiota e lo modulano correttamente, soprattutto i bifidi e Akkermansia.
"Esistono differenze significative nel microbiota dei pazienti con sclerosi multipla rispetto alla popolazione sana. Alcuni di questi microrganismi sono associati a un decorso della malattia peggiore, il che suggerisce il ruolo della composizione del microbiota intestinale come fattore predittivo della prognosi".
Aggiornamento 30/12/2019
Il microbiota è importante per l'assorbimento dei minerali
I probiotici in gravidanza, dopo il parto e dopo i 6 mesi riducono il rischio di dermatite atopica del 33%
Aggiornamento 31/12/2019
La dieta dovrebbe essere inserita tra le opzioni terapeutiche delle IBD, malattie infiammatorie croniche intestinali come morbo di Crohn e rettocolite ulcerosa. Tra le diete emergenti, la dieta dei carboidrati specifici, il protocollo autoimmune, la dieta semivegetariana, la dieta di esclusione per il Crohn, ma tutte hanno ancora evidenze insufficienti derivanti da studi piccoli e non controllati. Anche diete senza lattosio e basate sugli allergeni possono dare discreti risultati, ma la più indicata rimane quella FODMAP. Vitamina D, zinco e omega 3 hanno mostrato interessanti effetti tra i singoli nutrienti.
In generale si sta puntando sulla qualità nutrizionale e sull'esclusione degli alimenti industriali e di additivi, responsabili di permeabilità intestinale e modulazione del microbiota che possono essere alla base della malattia.
Aggiornamento 2/1/2020
Nella revisione sull'effetto delle diete nei disturbi dello spettro autistico (ASD), gli autori concludono che, essendo molto frequenti i problemi intestinali, le diete risultano molto interessanti. Tuttavia non è stato individuato un trattamento con risultati univoci e adatto a tutti, e "mancano dati scientifici conclusivi sull'effetto delle diete terapeutiche sull'autismo e, in quanto tale, non è possibile formulare raccomandazioni definitive per una terapia nutrizionale specifica come trattamento standard per l'ASD". Quelle con maggiore efficacia appaiono la dieta senza glutine e caseine (GFCF) e la supplementazione di alcune vitamine e probiotici. La dieta chetogenica e dei carboidrati specifici hanno potenziali da indagare ulteriormente. La dieta GFCF appare efficace in circa la metà delle persone. A cosa è dovuto questo? Glutine e caseine vengono maldigerite in alcuni soggetti, forse a causa di disbiosi, e la β-caseina A1 presente nei latticini porta alla formazione di β-casomorfina-7 (BCM7), sostanza in grado di entrare nel sangue in caso di permeabilità intestinale e creare problemi di riduzione del glutatione (e quindi stress ossidativo) .
Anche la sovracrescita di candida e delle sue ife sembra implicata, anche a causa della riduzione di lattobacilli
Aggiornamento 3/1/2020
Nelle IBD, malattie infiammatorie croniche intestinali, coesistono infiammazione e disbiosi, in un circolo vizioso che si autoalimenta (la disbiosi causa infiammazione e l'infiammazione crea disbiosi). Ma quale viene prima? Non si sa. "La relazione tra disbiosi e infiammazione nell'IBD è più dinamica della semplice relazione causa-effetto, l'uovo o la gallina". Ma soprattutto "le terapie per le IBD devono mirare sia all'infiammazione che al microbiota, non l'una o l'altra", e "per modificare con successo il microbiota a uno stato stabile e sano e ottenere la remissione dell'IBD, è necessario un approccio su più fronti che incorpori sia la riduzione dell'infiammazione che il ripristino del microbiota. Idealmente, approcci personalizzati che comportano un'analisi del microbiota e delle caratteristiche specifiche della risposta immunitaria della mucosa guideranno le nostre future terapie".
Aggiornamento 6/1/2020
Nei topi una dieta ad alto contenuto di fibre in gravidanza modula il microbiota e il sistema immunitario (induzione dei Treg) della prole in modo da ridurre il rischio di allergie e malattie autoimmuni
Aggiornamento 8/1/2020
"Si è ipotizzato che cambiamenti nella produzione, lavorazione e confezionamento degli alimenti (ad esempio l'uso di pesticidi, antibiotici, ormoni, conservanti, denaturazione con calore, detergenti e sostanze chimiche) siano collegati alle malattie allergiche direttamente o indirettamente". Nei topi il BPA (plastiche) altera il sistema immunitario (riduzione Treg) e la tolleranza agli alimenti.
"Le proteine glicate (AGEs), che si trovano in molti alimenti, in particolare dopo un riscaldamento molto elevato, come la cottura a microonde, la frittura e il barbecue, possono promuovere le risposte allergiche". Anche "l'esposizione a determinati farmaci durante l'infanzia, in particolare gli antagonisti del recettore H2 e gli antiacidi, aumenta il rischio di anafilassi alimentare ed esofagite eosinofila (EoE)".
Introdurre cibi troppo tardi (arachidi dopo un anno) aumenta il rischio di allergia. Carenza di vitamina D o un suo eccesso aumentano il rischio.
La dieta corretta riduce il rischio probabilmente modulando il microbiota.
Prebiotici e probiotici saranno probabilmente utili in futuro. La presenza di permeabilità intestinale è un meccanismo importante perché aumenta il contatto con gli antigeni.
Aggiornamento 9/1/2020
Un altro studio conferma l'idea che la celiachia, come altre malattie autoimmuni, sia dovuta al mimetismo molecolare, ossia sequenze di alcuni batteri che somigliano al glutine e scatenano una reazione verso di esso. Tra di essi P. aeruginosa e P. fluorescens
Aggiornamento 13/1/2020
Nei ratti ipertesi il kefir diminuisce la pressione arteriosa, migliora l'integrità della barriera intestinale e combatte la neuroinfiammazione
Aggiornamento 17/1/2020
Il microbiota della mamma che allatta influenza il rischio di allergie nel bambino. Infatti se nel primo mese il latte materno ha una scarsa varietà di batteri aumenta il rischio allergico. Per una buona varietà è indispensabile mangiare tanta fibra con una dieta corretta ed eventualmente assumere probiotici
Aggiornamento 19/1/2020
I topi con una dieta e un microbiota adeguati sono più resistenti all'influenza, e "costruire un intestino sano promuove un microbioma più equilibrato che ci aiuta a combattere i virus", grazie ai grassi a catena corta (SCFA) come il butirrato.
"I dati dimostrano che le fibre alimentari e gli SCFA possono proteggere da gravi infezioni influenzali riducendo il danno tissutale e aumentando l'immunità antivirale adattiva. Gli SCFA sono stati prevalentemente associati all'immunoregolazione e alla prevenzione di infiammazioni esagerate; tuttavia, il nostro lavoro evidenzia un duplice ruolo degli SCFA. Modulando le risposte innate, promuovendo meccanismi di protezione dei tessuti e stimolando un'immunità adattativa specifica, le fibre alimentari e gli SCFA possono creare un equilibrio immunitario che alla fine protegge dalla malattia".
Aggiornamento 21/1/2020
La presenza di antigeni degli acari nel latte materno, a causa di permeabilità intestinale e mancata proteolisi, può essere una causa di allergia alimentare nel bambino
Aggiornamento 28/1/2020
Nei bambini con autismo si osservano alterazioni nel profilo delle cellule immunitarie e delle citochine (molecole che interagiscono con il sistema immunitario), simili a quelle delle persone con malattie autoimmuni, con aumento dei Th-17 e riduzione dei Treg (che danno tolleranza immunologica), e più aumenta il rapporto tra queste cellule più la malattia è severa.
Una maggiore qualità della dieta, uso di probiotici, introito di omega 3 e fibre migliorano la qualità del microbiota materno e così di quello del figlio allattato. Una maggiore diversità di batteri a un mese di vita riduce il rischio di allergie negli anni seguenti, così come i probiotici in gravidanza tramite la produzione di anticorpi Ig-A.
Aggiornamento 17/2/2020
L'articolo del Prof Alessio Fasano, docente ad Harvard, inizia così "Venticinque secoli fa, quando Ippocrate affermò che "Tutte le malattie iniziano nell'intestino", ebbe un'intuizione incredibile che solo recentemente è stato pienamente apprezzata a causa di nuove intuizioni sulla patogenesi di molte malattie infiammatorie croniche (CID) che affliggono l'umanità".
Oggi sappiamo che la permeabilità intestinale può essere concausa di molte malattie, perché permette agli antigeni alimentari e a batteri o loro derivati di entrare nel circolo sanguigno (endotossemia) e attivare cellule immunitarie T, facendo perdere la tolleranza immunitaria e inducendo allergie e infiammazione.
Tra le cause di induzione della zonulina, la proteina che provoca permeabilità, vengono indicate disbiosi, in particolare SIBO, e il glutine (altri fattori conosciuti sono alcol e stress).
Quali patologie sono probabilmente legate alla condizione di leaky gut? Invecchiamento, malattie autoimmuni (celiachia, diabete di tipo 1, IBD, sclerosi multipla, spondilite anchilosante), disordini metabolici (obesità, diabete di tipo 2, diabete gestazionale, steatosi epatica), IBS, tumori (glioma e carcinoma epatico), patologie neurologiche (autismo, depressione, schizofrenia, fatica cronica).
Aggiornamento 27/2/2020
Le persone con IBD, in particolare rettocolite ulcerosa, hanno ridotte quantità della famiglia delle Ruminococcaceae, batteri noti per trasformare i sali biliari da primari in secondari. Infatti questi ultimi sono ridotti nelle persone con malattia. Fornire sali biliari secondari migliora la malattia nel modello animale
Aggiornamento 12/3/2020
La permeabilità intestinale di frammenti di Enterobatteriacee come Escherichia–Shigella, Serratia gioca un ruolo importante nel diabete, perché dà una reazione infiammatoria che impedisce all'insulina di abbassare la glicemia (resistenza insulinica)
Aggiornamento 14/3/2020
Tra le diete di esclusione che funzionano nella sindrome dell'intestino irritabile, FODMAP e glutenfree. È difficile valutarne l'efficacia in studi sulla popolazione anche perché bisognerebbe trovare alimenti inerti da usare nella popolazione di controllo.
Le diete funzionano attraverso vari meccanismi, come un effetto diretto del cibo, il cambiamento del microbiota intestinale e l'attivazione immunitaria.
Solitamente le persone con IBS hanno carenza di bifidobatteri e eccesso di Enterobatteriacee e Bacteroides. La dieta FODMAP può anche indurre carenza di bifidi, che può essere corretta sinergicamente con i probiotici
I classici test allergici sulle Ig-E non sono in grado di mettere in evidenza l'infiammazione e la risposta immunologica al cibo nell'intestino irritabile.
Il grano può indurre infiammazione non solo tramite il glutine, ma anche con l'ATI (inibitore della tripsina), e questo succede soprattutto in caso di carenza di Pseudomonas e lattobacilii (rispettivamente), inducendo risposte immunitarie innate e aumentando la permeabilità intestinale, l'attivazione colinergica e la dismotilità intestinale.
Aggiornamento 19/3/2020
Lo studio dell'interazione tra dieta e disordini autoimmuni è stato recentemente soprannominato "immunodietetica". I componenti del cibo e i loro effetti sul microbioma intestinale sono tra i principali corresponsabili della malattia autoimmune, ma sono spesso trascurati. La perdita del meccanismo di tolleranza orale può indurre il sistema immunitario a reagire al cibo che il corpo usa per vivere. Molti alimenti condividono le sequenze con alcuni tessuti umani; questo "mimetismo molecolare" può indurre o esacerbare malattie autoimmuni. Latte, grano, acquaporine vegetali, legumi, proteine ricche di glicina (carni bianche e rosse, cereali, soia, gelatina ecc), glucani, pectine, tropomiosina del gambero, Saccharomyces cerevisiae (lievito) e carne di maiale sono alcuni esempi di alimenti che condividono una significativa omologia con diverse proteine dei tessuti umani. Le lectine e le agglutinine sono proteine che legano i carboidrati di membrana, e sono presenti in microrganismi, piante e animali, sono resistenti alla digestione. "Le lectine non digerite che riescono a penetrare le barriere digestive possono avere effetti devastanti sul corpo, tra cui problemi digestivi, carenze nutrizionali, danni intestinali e intestino permeabile, una porta verso l'autoimmunità. La lectina iniettata nei topi induce il legame della lectina con le IgG, seguita dall'aggregazione delle IgG e dalla formazione di IgM anti-IgG o fattore reumatoide (RF), inducendo così l'artrite reumatoide." Altre malattie autoimmuni hanno probabilmente altri fattori alla base. "Inoltre, le lectine possono legarsi all'endometrio umano, agli spermatozoi e agli ovuli, provocando una reazione autoimmune che potrebbe causare infertilità negli uomini o nelle donne". "Alcuni alimenti possono aiutare a mantenere la tolleranza orale e un sistema digestivo sano, mentre gli alimenti dannosi possono favorire la crescita di batteri dannosi e portare al rilascio di tossine batteriche, indebolendo le barriere intestinali. Inducendo la permeabilità intestinale, i batteri o i loro antigeni possono entrare nella circolazione, dove la reazione immunitaria contro di loro provoca la produzione di anticorpi. Poiché il tessuto umano è imitato da così tanti antigeni batterici intestinali, gli anticorpi e le cellule T che reagiscono contro gli antigeni batterici possono attaccare le proteine che imitano i batteri presenti nel tessuto umano e quindi innescare una risposta autoimmune. Evitare alimenti che contengono epitopi autoimmuni o componenti che inducono modificazioni post-traduzionali delle proteine alimentari o che hanno la capacità di modificare selettivamente il microbiota intestinale, potrebbe migliorare i sintomi nei pazienti con la corrispondente malattia autoimmune". Come si può leggere quasi qualsiasi categoria di cibo è potenzialmente immunogena quindi solo una dieta tagliata su misura può agire correttamente.
I bambini con ADHD sembrano avere maggiore quantità di ruminococchi
Aggiornamento 30/3/2020
Una riduzione della funzione cognitiva si può avere in caso di obesità, dieta povera di nutrienti e alterato microbiota (e le 3 cose spesso sono presenti insieme), a causa dell'alterato profilo metabolico e ormonale e della permeabilità intestinale
Aggiornamento 1/4/2020
I bambini svezzati precocemente hanno ad un anno alterazioni della flora batterica e dei grassi a catena corta (SCFA), in particolare il butirrato, un grasso antinfiammatorio e immunomodulatore. Questo "potrebbe essere correlato a stress ossidativo, obesità e disturbi del sistema immunitario attraverso cambiamenti nel microbiota intestinale in via di sviluppo".
Aggiornamento 3/4/2020
Secondo qualcuno le epidemie possono essere anche una conseguenza del disallineamento immunitario dovuto alla perdita di specie microbiche nel'intestino
Aggiornamento 6/4/2020
Le donne che hanno nel loro intestino un batterio, Prevotella copri, durante la gravidanza, hanno inferiore rischio di avere figli con allergie alimentari. Questo batterio si riduce con diete di tipo occidentale, ma in alcuni casi può essere anche considerato patogeno. Aggiungono i ricercatori: "i nostri risultati supportano l'importanza di fare attenzione alle terapie antibiotiche durante la gravidanza e consigliare una dieta che ottimizza la salute del microbiota intestinale materno".
Esiste un legame tra disbiosi intestinale e emicrania. I batteri possono indurre un rilascio di TNFalfa, una sostanza infiammatoria, dalla microglia (tessuto cerebrale). Se invece abbiamo i batteri (e l'alimentazione) giusti, essi rilasciano SCFA che stimolano correttamente la microglia e riducono l'emicrania.
Aggiornamento 7/4/2020
Una formulazione di prebiotici e nutrienti vegetali, fatta da curcumina, aloe vera, olmo sdrucciolevole, gomma di guar, pectina, olio di menta piperita, può essere benefica per le persone con problemi gastrointestinali. In uno studio che ha considerato disturbi da reflusso e/o simili a IBS, (indigestione, bruciore di stomaco, nausea, costipazione o diarrea, dolore addominale, flatulenza, e collegati come fatica e ansia) senza gruppo di controllo, "la formula ha ridotto significativamente la permeabilità intestinale, migliorato il profilo microbico e ridotto la necessità di farmaci per il reflusso nel 40% dei partecipanti che assumevano regolarmente antiacidi prima dello studio. La guarigione della mucosa intestinale ha consentito al 40% -50% dei partecipanti di reintrodurre potenziali fattori scatenanti alimentari come cibi FODMAP, latticini, cibi ricchi di carboidrati e/o cibi acidi o piccanti senza ricaduta dei sintomi gastrointestinali. La qualità della vita (funzione fisica, energia, umore e sonno) è migliorata tra il 60 e l'80%". Il microbiota è migliorato (aumento di lattobacilli, bifidi e clostridi non patogeni) e anche la forma delle feci secondo la scala di Bristol.
Aggiornamento 21/4/2020
È stato dimostrato che una maggiore permeabilità intestinale è coinvolta in diverse malattie associate a infiammazione cronica di basso grado, tra cui obesità e sindrome metabolica. La somministrazione di kefir ha ridotto la zonulina (marker di permeabilità) e migliorato l'umore in un gruppo di persone sovrappeso
Aggiornamento 26/4/2020
Per ridurre il rischio di allergie alimentari, le linee guida ufficiali "incoraggiano l'allattamento al seno e l'introduzione precoce di alimenti allergenici per i bambini a rischio di allergia alimentare, con un'enfasi sulla diversità alimentare, frutta, verdura, pesce e fonti alimentari di vitamina D durante la gravidanza, l'allattamento e la prima infanzia per tutti i bambini". Probiotici, prebiotici, HMO, omega 3, possedere cani sono tutti fattori che potrebbero ridurre il rischio. Una dieta materna ricca di dolci e grassi trans è stata recentemente associata ad un aumentato rischio di allergia alimentare nei neonati suscettibili.
Aggiornamento 6/5/2020
I simbiotici sono efficaci nella riduzione del peso
I bambini che hanno maggior quantità di UMFA (acido folico non metabolizzato), dovuto a varianti genetiche che riducono la sua metabolizzazione, hanno maggior rischio di allergie alimentari
Aggiornamento 26/5/2020
Il complesso rapporto tra vita moderna, microbiota e sistema immunitario alterati e allergie alimentari
Aggiornamento 2/6/2020
La preeclampsia (gestosi), condizione caratterizzata da ipertensione, proteinuria ed edema in gravidanza, si può associare a disbiosi intestinale, con aumento di Fusobacterium e Veillonella e riduzione di Faecalibacterium e Akkermansia. I primi provocano infiammazione della placenta. Inutile sottolineare come l'alimentazione scorretta sia associata con queste alterazioni. L'analisi del microbiota e la sua correzione potrebbero aiutare a prevenire la patologia.
Aggiornamento 4/6/2020
Approcci per prevenire le allergie alimentari
"Sapere come prevenire le allergie alimentari contribuirebbe ad alleviare gli impatti sulla salute, sociali e finanziari. Storicamente, gli sforzi per prevenire le allergie alimentari si sono basati sull'identificazione di neonati a rischio e sulla raccomandazione di evitare potenziali allergeni. Questo approccio appare superato. Le strategie per facilitare una maggiore tolleranza immunologica, inclusa l'introduzione precoce di potenziali allergeni alimentari, hanno risultati incoraggianti che potrebbero aiutare a ottimizzare la prevenzione basata sulla comunità". In pratica appare oggi meglio introdurre precocemente il cibo per indurre la tolleranza mentre aspettare può favorire l'insorgere di allergia. Anche evitare i cibi in gravidanza non è utile. gli allergeni devono essere introdotti separatamente. L'uovo deve essere cotto. L'olio di pesce (omega 3) assunto in gravidanza e allattamento può prevenire le allergie alimentari nei soggetti a rischio. Prebiotici e probiotici possono avere un piccolo effetto preventivo.
La permeabilità intestinale (leaky gut) è presente quando c'è un tumore del sistema digerente. Mentre prima si pensava che essa fosse una conseguenza dell'infiammazione indotta dal tumore, oggi si sa che è antecedente, collegata a IBD, pancreatite, epatite ecc, ed è causata da disbiosi, metaboliti batterici tossici, antigeni alimentari. Questa condizione quindi aumenta il rischio di tumore pancreatico, epatico, intestinale ecc. La diversità batterica riduce il rischio, e percorsi appositi che ristabiliscano la funzione di barriera possono ridurre il rischio di tumore.
Aggiornamento 6/6/2020
Aggiornamento 9/6/2020
Asma, allergie e dermatite atopica sono tutte caratterizzate in genere da una risposta immunitaria di tipo 2 (citotossica). Le cellule dendritiche (DC), se stimolate da vitamina D, retinolo (vitamina A), adenosina, un microbiota normale e loro prodotti (SCFA) e flavonoidi (antiossidanti delle piante) egli stessi allergeni, portano alla generazione di Treg, cellule immunitarie che danno tolleranza. In caso contrario (scarsa esposizione agli allergeni, infezioni virali e di vermi, disbiosi) stimolano le cellule Th2 che non hanno tolleranza e provocano infiammazione
Aggiornamento 16/6/2020
La dieta a basso tenore di nichel, insieme a una correzione apposita della disbiosi (putrefattiva, fermentativa o mista) con probiotici mirati può migliorare la salute di persone con SNAS (sindrome da allergia sistemica al nichel)
Aggiornamento 20/6/2020
I metalli (cadmio, alluminio, nickel, oro, argento, stagno e soprattutto mercurio e piombo) possono essere attivatori delle malattie autoimmuni. Perché alcuni le sviluppano e altri no? "Nell'uomo, la suscettibilità agli effetti degli xenobiotici può essere dovuta alle disfunzioni geneticamente determinate nei sistemi di disintossicazione, tra cui la coniugazione con glutatione, l'acetilazione e altri sistemi dipendenti dal citocromo P450, e dal fenotipo della metallotioneina (proteine che legano i metalli pesanti)". Tenendo conto della suscettibilità del sistema immunitario, "la capacità di disintossicare gli xenobiotici, insieme alla suscettibilità individuale al metallo, è probabilmente il fattore più critico nel risultato dell'esposizione al metallo". Il fatto che l'uomo non produca vitamina C, che allevia lo stress ossidativo, può differenziarlo dai modelli animali. "L'infiammazione indotta da metallo può alterare l'asse ipotalamo-ipofisi-surrene (HPA) e quindi contribuire alla fatica e ad altri sintomi non specifici che caratterizzano i disturbi legati alle malattie autoimmuni. Gli effetti tossici di diversi metalli sono mediati attraverso la formazione di radicali liberi, disturbi della membrana cellulare o inibizione degli enzimi". Mercurio e piombo alterano anche il sistema dopaminergico (ricompensa), potenziando l'effetto. Inoltre, [Ad esempio,] la tossicità del mercurio può influenzare l'asse cerebrale del microbiota intestinale (GMBA), e quindi lo sviluppo neuronale ... e ... Ciò potrebbe verificarsi perché il microbiota intestinale è un attore attivo nella regolazione della proprietà tossica di molte specie metalliche, incluso il mercurio".
Aggiornamento 16/7/2020
La dieta ad alto contenuto in grassi "in collaborazione" con gli antibiotici può predisporre per le malattie infiammatorie intestinali. Questo avviene anche alterando la bioenergetica della cellula (mitocondri disfunzionali) e il microbiota (disbiosi con aumento delle Enterobatteriacee).
Aggiornamento 19/7/2020
La candida può essere un innocente abitante dell'intestino, ma anche dare problemi. In particolare influenza funzionalità cerebrale, immunità e sensibilità viscerale, rilasciando cortisolo e istamina, 2 ormoni/neurotrasmettitori, ed è così correlata con la sindrome dell'intestino irritabile
Aggiornamento 11/8/2020
I postbiotici, metaboliti o frammenti derivati da microrganismi probiotici, sono una strategia terapeutica e preventiva attraente nella medicina moderna. Secondo i dati attuali, "i postbiotici hanno effetti pleiotropici, comprese proprietà immunomodulatorie, antinfiammatorie, antiossidanti e antitumorali". I dati dimostrano efficacia nelle allergie, compresa la dermatite atopica,, nella modulazione del sistema immunitario, nella prevenzione delle infezioni, nelle malattie metaboliche e legate allo stress ossidativo.
Aggiornamento 13/8/2020
Il regno dei funghi, che è ben rappresentato nel nostro intestino (micobiota), può produrre delle molecole che possono essere benefiche o dannose. "Gli ecosistemi disbiotici, oltre all'esposizione a micotossine e metaboliti cellulari fungini - di origine sia interna che esterna, questi ultimi per esposizione alimentare o ambientale - possono non solo indurre stress epatico, immunitario e linfatico cellulare, ma anche influenzare la progressione della disbiosi intestinale stimolando, ad esempio, le risposte immunitarie e microbiche dell'ospite". L'uso di latte artificiale e la dieta di tipo occidentale determinano variazioni delle comunità fungine intestinali. "... Lungi dall'essere esclusivamente organismi benefici, i funghi (in particolare i funghi filamentosi che formano spore) hanno una lunga e famigerata storia di contaminazione degli alimenti, causando danni sia agli esseri umani che al bestiame attraverso i loro metaboliti secondari tossici ..."
"... Proprio come l'alimentazione e la dieta possono avere un impatto sul micobiota dei mammiferi, anche i componenti fungini della dieta possono modulare le comunità batteriche e fungine nei cibi preparati e nel tratto gastrointestinale ..."
I prodotti fungini possono così influenzare il metabolismo e la progressione della malattia (figura 2):
La tossina candidalisina, secreta dalla Candida albicans, induce danni al fegato favorendo il rilascio di IL-1β da parte dei fagociti epatici. Aspergilli e altri producono aflatossine, che infestano alcuni cereali conservati e sono cancerogene, epatotossiche e nefrotossiche.
I β-glucani sulla superficie della parete cellulare fungina riducono l'assorbimento intestinale del colesterolo e riducono l'espressione epiteliale del trasportatore del glucosio SGLT-1.
I β-glucani potrebbero rallentare lo svuotamento gastrico, riducendo così i trigliceridi e l'assorbimento del colesterolo.
L'abbondanza dei funghi come la candida riduce la presenza dei batteri buoni come i bifidi. Nell'adulto la candida prolifera con una dieta vegetale e con i carboidrati, mentre i grassi saturi la inibiscono. Candida e S. cerevisiae sembrano correlati anche con l'autoimmunità betacellulare (diabete di tipo 1) e la steatosi epatica. S. boulardii può invece modulare favorevolmente intestino e sistema immunitario.
Aggiornamento 11/8/2020
Il rapido aumento dei disturbi del sistema immunitario, come nel caso delle malattie allergiche, è fortemente associato a una ridotta esposizione ai microrganismi nel primo periodo di vita. Il microbiota intestinale stimola parzialmente il sistema immunitario e la particolare composizione del microbiota intestinale può influire sul rischio di malattie allergiche. Pertanto, questi risultati suggeriscono un approccio terapeutico per probiotici e prebiotici utilizzati nelle malattie allergiche.
"In generale, i probiotici utilizzano i principali meccanismi per migliorare i sintomi clinici nei pazienti con malattie allergiche e prevenirli, tra cui: (1) la soppressione delle risposte Th2 in favore di quella Th1; (2) produzione di butirrato e maggiore induzione della tolleranza; (3) aumento di IL-10 e diminuzione dell'infiammazione; (4) diminuzione del livello di eosinofili e di IgE sieriche specifiche; (5) aumentare il rapporto IFN-gamma/IL-4; (6) aumentare le cellule Treg e indurre le loro risposte; (7) aumentare le risposte TGF-beta e inibire le risposte allergiche; e (8) ridurre l'espressione della metalloproteinasi 9 e l'infiltrazione cellulare". I meccanismi d'azione sono divisi in 2 gruppi:
1. i meccanismi fisiologici includono: a) I probiotici creano condizioni competitive e inibiscono l'aderenza batterica allo strato mucoso, b) Migliora l'integrità della barriera epiteliale e migliora la funzione di barriera, c) La produzione di muco può anche essere aumentata dai probiotici che stimolano le cellule caliciformi portando all'aumento della mucina e quindi alterazione della colonizzazione e della condizione di persistenza.
2. Meccanismi immunologici: a) I probiotici, direttamente e indirettamente, influenzano le cellule epiteliali e modulano le vie di segnalazione che portano a una ridotta espressione di citochine infiammatorie sopprimendo la segnalazione di NF-kB, b) La modalità d'azione primaria dei probiotici include il ripristino dell'equilibrio tra le citochine Th1 e Th2 e il potenziamento delle citochine Th2 (IL-4, IL-5, IL-13), c) I probiotici con i loro prodotti stimolano le cellule dendritiche e potrebbero portare all'induzione della differenziazione Treg delle cellule CD4 + Foxp3 + Treg e alla produzione di TGF-beta e IL-10, d) I probiotici modificano i profili delle citochine attraverso gli effetti sulle cellule dendritiche e quindi aumentano la produzione di IgA e IgG4 secretorie da parte delle cellule B e la riduzione delle IgE allergene-specifiche da parte delle cellule B.
Tra gli studi condotti sull'uomo [recensiti qui] ... i ceppi che possono influenzare l'AD (dermatite atopica) potrebbero essere L. acidophilus, Lacticaseibacillus rhamnosus (LGG), B. animalis, L. paracasei, L. fermentum e L. plantarum ... ”
"... La combinazione era generalmente accompagnata dalla soppressione delle risposte Th2 e dal miglioramento dei sintomi clinici della dermatite atopica .."
"... Negli studi sull'allergia alle proteine del latte bovino (CMA), l'uso di LGG, che ha favorito la produzione di butirrato, ha aumentato l'induzione della tolleranza nei bambini, ma non è stato osservato alcun effetto significativo in presenza di B. lactis Bb-12 e L. casei sull'allergia al latte vaccino ... "
"... Il miglioramento dei sintomi della rinite allergica (AR) è stato segnalato per diversi ceppi come LGG, L. reuteri, L. casei, L. salivarius, B. Longum, B. infantis, B. breve, B. gasseri, B. bifidum G9-1 e Lactococcus lactis, tutti efficaci nel ridurre i sintomi clinici ... "
"... Nei pazienti con asma, l'effetto di L. acidophilus, L. reuteri e Clostridium butyrate ... [ha portato i ricercatori a dimostrare l'efficacia di] L. reuteri che aumenta l'IL-10 e diminuisce l'infiammazione, portando a un miglioramento dei sintomi in questi pazienti ...”
Potenziali rischi sono legati alle persone immunodepresse e immunocompromesse e al potenziale, in alcuni casi, aumento di aderenza di alcuni patogeni alla membrana intestinale.
Aggiornamento 26/8/2020
La personalità e l'umore si possono legare al microbiota (oltre ad avere caratteristiche ereditarie)
Aggiornamento 27/8/2020
Un ceppo del batterio probiotico L. reuteri ha una sequenza proteica che somiglia a MOG, la proteina che gestisce la mielinizzazione dei nervi. Se il batterio stimola il sistema immunitario, può così portare, tramite mimetismo molecolare, i globuli bianchi ad attaccare le proprie strutture nervose, come accade nella sclerosi multipla
Aggiornamento 3/9/2020
Individuati anticorpi che potrebbero aiutare a diagnosticare la sensibilità al glutine. Fanno parte della classe delle IgG. "Abbiamo scoperto che le cellule B dei pazienti affetti da celiachia hanno prodotto un profilo di sottoclasse di anticorpi IgG con un forte potenziale infiammatorio che è legato all'attività autoimmune e al danno delle cellule intestinali", afferma Alaedini. "Al contrario, i pazienti con sensibilità al glutine non celiaca hanno prodotto anticorpi IgG associati a una risposta infiammatoria più contenuta". "Se riusciamo a guidare specifiche cellule immunitarie dei pazienti celiaci verso una minore infiammazione, potremmo essere in grado di prevenire o ridurre la gravità della reazione immunologica al glutine".
Aggiornamento 5/7/2020
"... Un microbiota diversificato e benefico è fondamentale nella protezione contro le malattie allergiche e l'esposizione orale precoce agli allergeni alimentari è efficace nel prevenire allergie alimentari specifiche".
Aggiornamento 16/9/2020
La malattia di Kawasaki, una delle principali cause di problemi cardiaci nei bambini, sembra correlata con la disbiosi intestinale.
Nello specifico ...
"... Enterococcus, Acinetobacter, Helicobacter, Lactococcus, Staphylococcus e Butyricimonas nei bambini con malattia di Kawasaki in fase acuta erano significativamente più alti rispetto ai bambini sani ... [e] i livelli dei biomarcatori dell'infiammazione sistemica, inclusi IL-2, IL-4, IL-6, IL- 10, TNF-α e INF-γ, erano significativamente elevati nei bambini con malattia di Kawasaki acuta ... " "... I nostri risultati ... [dimostrano anche la maggiore] abbondanza relativa di Ruminococcus, Blautia e Roseburia nella fase non acuta ..." "... Abbiamo anche scoperto che i produttori di SCFA come Prevotella, Dialister, Clostridium, Eubacterium, Roseburia e Megasphaera era significativamente ridotti nei bambini con malattia di Kawasaki acuta rispetto ai controlli sani ..." "... [Nella nostra] analisi di correlazione [abbiamo] dimostrato che Enterococcus e Helicobacter erano correlati positivamente con IL-6 [, un'osservazione che] ... non è mai stata riportata in precedenza nella malattia di Kawasaki ..."
'Enterococcus, sebbene faccia parte dei normali microbi intestinali nell'uomo, è noto per aumentare i fattori di virulenza associati alla formazione di biofilm e alla sovraregolazione di una grande varietà di molecole biologicamente attive, portando a infezioni nosocomiali che interessano il flusso sanguigno, le vie urinarie, il peritoneo e il tratto respiratorio , compresi i superantigeni, e inducono anche una forte risposta infiammatoria, quando si è sotto stress '...
"... [A tal fine è degno di nota che] queste caratteristiche fanno parte della patogenesi della malattia di Kawasaki ..."
In conclusione…
"... Abbiamo ipotizzato che la disbiosi del microbiota intestinale possa partecipare alla patogenesi della malattia di Kawasaki amplificando l'infiammazione sistemica ..."
"... [In effetti, i risultati di] questo studio suggeriscono che l'alterazione del microbiota intestinale è strettamente associata all'infiammazione sistemica, che fornisce una nuova prospettiva sull'eziologia e la patogenesi della malattia di Kawasaki ... [sebbene] ulteriori studi dovrebbero essere condotti a questo proposito ... "
Aggiornamento 20/9/2020
Quali sono i fattori che aumentano il rischio di allergie? Durante la gravidanza il fumo, l'inquinamento, l'obesità, l'uso di antibiotici e la predisposizione genetica, il parto cesareo. Dopo la nascita l'uso di antibiotici, alcune infezioni virali, il fumo passivo, poca attività all'aperto, carenza di vitamina D, dieta occidentale (con troppi omega 6 e pochi omega 3), introduzione ritardata dei cibi. In generali tutti i fattori che influenzano il microbiota quindi, compresi funghi come Candida, Malassezia e Aspergillus. L'uso di probiotici e prebiotici può ridurre il rischio.
Aggiornamento 27/9/2020
I fattori ambientali che determinano la celiachia non sono ancora certi. Il microbiota è comunque, per quanto mi riguarda, un fattore sicuro (e non che cambia dopo come effetto, come qualcuno dice). In uno studio prospettico si sono individuate particolari specie che poi si assoceranno a maggiore rischio di diventare celiaci. L'uso di probiotici e prebiotici potrebbe ridurre i problemi di chi tende ad avere sintomi nonostante la dieta gluten-free (circa il 20%)
"La risposta immunitaria nella patogenesi della celiachia è mediata dalla risposta sia delle cellule B che delle cellule T. Il microbiota intestinale, sia microbi commensali che patobionti, potrebbe contribuire allo sviluppo della celiachia influenzando la digestione del peptide del glutine, la stimolazione delle cellule dendritiche e TReg, lo stress delle cellule epiteliali, la modulazione della permeabilità intestinale e la produzione di citochine pro-infiammatorie".
Anche microbiota orale e viroma possono concorrere. In generale si è osservato riduzione dei lattobacilli e dei bifidi e aumento dei proteobatteri. Metodo di nascita, uso di antibiotici e dieta sono altri probabili fattori, anche se per nessuno si è giunti al grado di certezza sulla correlazione causa-effetto (come spesso accade in patologie multicausali). Oltre a B. infantis, anche altri approcci possono ridurre l'infiammazione del celiaco
Aggiornamento 4/10/2020
Perché l'alimentazione odierna favorisce l'aumento delle malattie non trasmissibili e a volte la sola dieta non è sufficiente a correggere i problemi? La scarsa quantità di fibra porta a perdita di specie batteriche benefiche che la sola dieta non sempre ripristina, e favorisce i degradatori di muco, che invece aumentano l'infiammazione.
"I processi industriali riducono significativamente la quantità di contenuto di MAC (carboidrati accessibili al microbiota, fibre in sostanza) nella dieta occidentale, rispetto al contenuto della dieta dei nostri antenati. Il basso consumo di MAC non solo ha impatti dannosi sul microbiota intestinale in particolare, ma anche sull'ospite nel suo insieme. Favorisce lo sviluppo di malattie e aumenta la mortalità, come dimostrato da studi preclinici e clinici. Il basso consumo di MAC nel corso delle generazioni porta alla completa scomparsa di ceppi batterici benefici in uno studio preclinico. […] L'unico trattamento in grado di correggere questo “microbiota alterato” è costituito da interventi dietetici e probiotici combinati. Ciò potrebbe spiegare la scarsa efficacia dei trattamenti esclusivi con i probiotici negli esseri umani, poiché i probiotici potrebbero non crescere in un ambiente disbiotico, perché non abbinati a una dieta ricca in fibra. Pertanto, gli interventi dietetici insieme alla somministrazione di ceppi batterici benefici potrebbero essere un trattamento economico per gestire la maggior parte delle malattie dello stile di vita occidentali non trasmissibili" come asma, allergie, sindrome metabolica ecc.
Aggiornamento 7/10/2020
Mentre anni fa si era costretti a discutere sull'esistenza o meno della permeabilità intestinale, vista come cosa antiscientifica, come se al primo anno di università non ci insegnassero della presenza dei desmosomi e delle giunzioni strette e serrate, oggi si parla tranquillamente del suo legame con le malattie cardiovascolari (insufficienza cardiaca, infarto acuto, aterosclerosi e ipertensione) e non solo, e si propone la sua gestione come opzione terapeutica.
Aggiornamento 12/10/2020
La Candida albicans (come altre sue parenti) è un patogeno opportunista dell'intestino, che può passare da essere commensale innocuo a una forma dannosa. La dieta occidentale, ricca di zuccheri e oli raffinati, e l'uso di antibiotici creano, anche attraverso gli acidi biliari, le condizioni per favorire la proliferazione della candida e il suo passaggio alla forma di ifa invasiva. La candida prolifera con il glucosio ma può adattarsi ad altre fonti energetiche come il lattato. È in grado di produrre la PGE2, una prostaglandina che "adatta" l'intestino alle sue esigenze, ma induce nausea, diarrea e vomito, riduce le difese immunitarie. La crescita della Candida porta a una risposta dei linfociti Th17, che può aggravare le malattie respiratorie come l'asma.
Nei modelli animali la candidalisina, la tossina rilasciata dalla candida, promuove la steatosi epatica legata all'alcol, e nell'uomo si associa a malattia più grave e maggiore mortalità
Aggiornamento 24/10/2020
"La tolleranza immunologica è un fattore fondamentale responsabile della presenza microbica nel corpo umano. Per sopravvivere con successo come commensale intestinale, un microbo deve sviluppare varie strategie per sfuggire alla risposta immunitaria dell'ospite ... [e] di conseguenza, i commensali hanno adottato vari metodi per regolare la risposta immunitaria dell'ospite come l'immunosoppressione basata sugli acidi grassi a catena corta (SCFA), la regolazione della attività innata delle cellule linfoidi e produzione di cellule Treg". In pratica i batteri rilasciano acidi grassi che regolano la risposta immunitaria e consentono la convivenza col corpo umano che li ospita.
Questa tolleranza può essere una chiave nelle malattie autoimmuni.
"L'intestino umano è continuamente esposto ad antigeni originati da alimenti, commensali e altri microbi. L'esposizione a questi antigeni evoca risposte immunitarie innate e adattive dell'ospite per proteggerli dall'insorgenza di qualsiasi infezione. Dal punto di vista dell'ospite, sembra vantaggioso; tuttavia, potrebbe essere dannoso per l'omeostasi intestinale. Di conseguenza, è necessario stabilire un equilibrio tra i segnali infiammatori e regolatori dell'ospite. I commensali aiutano nella proliferazione e nella ritenzione delle cellule Treg del timo (cellule immunitarie importanti nella tolleranza)". L'alterazione del microbiota è alla base di molte malattie, quindi "lo stadio dell'alterazione può fornire un dato sul trattamento, se la disbiosi può essere trattata utilizzando determinati agenti antimicrobici, prebiotici o probiotici, o semplicemente migliorando la dieta".
Aggiornamento 9/11/2020
Quale dieta nella IBS (sindrome dell'intestino irritabile)? La dieta FODMAP è efficace, ma può esserlo come una dieta che elimini i cibi "trigger" (attivatori), caffeina, alcol. Queste diete però devono favorire la reintroduzione, perché eliminare per lunghi periodi alimenti può alterare il microbiota negativamente. Tra gli integratori, i probiotici possono aiutare ma è difficile trovare qualcosa che vada bene per tutti, mentre la fibra di psillio ha mostrato efficacia e l'olio di menta piperita riduce i sintomi.
Aggiornamento 22/11/2020
I bambini con autismo hanno alto rischio di soffrire di sensibilità alimentari (allergie e intolleranze), con tutte le conseguenze del caso, intestinali e non
Aggiornamento 27/11/2020
Le persone con tiroidite di Hashimoto hanno alterazioni nel microbiota, e quando è presente anche l'ipotiroidismo è presente in particolare una specie, Phascolarctobacterium, che potrebbe essere coinvolta nella progressione della malattia.
Aggiornamento 8/12/2020
Seppur con alcune limitazioni, i probiotici appaiono utili nelle artriti, in particolare nell'artrite reumatoide e soprattutto i mix di lattobacilli e bifidi. L'effetto è evidenziato anche da una riduzione dei marker di infiammazione
Aggiornamento 12/12/2020
Gli effetti degli additivi alimentari sul microbiota, possono predisporre all'IBS
Aggiornamento 14/12/2020
I probiotici possono essere utili in persone celiache che continuano ad avere problemi nonostante la dieta senza glutine
Aggiornamento 28/12/2020
Le persone con intolleranza all'istamina sembrano avere pochi bifidobatteri e aumentata quantità di proteobatteri. Sono inoltre presenti infiammazione e permeabilità intestinale, con riduzione dell'enzima DAO che degrada l'istamina, portando a un possibile circolo vizioso
Aggiornamento 2/1/2021
L'intolleranza all'istamina può verificarsi quando si introduce istamina con la dieta, quando si hanno certi batteri che la aumentano e quando non si hanno livelli sufficienti di enzima che la degrada (DAO). I sintomi possono essere gastrointestinali aspecifici, cutanei (rossore, eczema, prurito), cardiaci (tachicardia, collasso), respiratori (rinorrea, congestione nasale, starnuti), (neurologici (emicrania e vertigini).
La dieta a basso contenuto di istamina e la supplementazione con l'enzima possono ridurre i sintomi.
Aggiornamento 8/1/2021
I batteri rilasciano delle sostanze che modulano i segnali del dolore (nocicezione). Così se abbiamo batteri amici, la sensibilità al dolore si riduce, se ci sono batteri patogeni soffriamo di più, anche per stimoli banali o in condizioni come l'intestino irritabile.. Anche la candida è un patogeno opportunista capace di indurre le vie del dolore e dell'infiammazione con i suoi metaboliti (β-glucani, ATP) e non innocuo come qualcuno dice. Inoltre microbi intestinali utilizzano e/o producono neurotrasmettitori come catecolamine, acido γ-amminobutirrico (GABA) e serotonina, che hanno profondi effetti su umore e condizione psicofisica.
.L'alimentazione è uno dei primi fattori ad influenzare il microbiota. C'è da stupirsi se con la dieta i dolori si riducono?
Aggiornamento 19/1/2021
Quasi un terzo delle IBS (sindrome dell'intestino irritabile) può iniziare dopo una gastroenterite infettiva, e il dolore può essere attivato dall'introduzione di alcuni antigeni alimentari, per i quali manca la tolleranza orale. Il dolore sembra mediato dall'attivazione dei mastociti.
"Questi dati indicano che un'infezione batterica gastrointestinale può rompere la tolleranza orale verso un antigene alimentare e provocare una risposta immunitaria adattativa verso gli antigeni alimentari, con conseguente aumento della permeabilità intestinale e segnalazione anormale del dolore in caso di riesposizione all'antigene".
Inoltre, in un piccolo esperimento su volontari, somministrando alcuni noti antigeni (glutine, grano, soia, latte), essi hanno evocato risposta infiammatoria e dolore, tramite istamina, nelle persone con IBS ma non nei volontari sani (se non 2 casi). Nessuno era allergico a tali antigeni, indicando vie "alternative" all'allergia classica (Ig-E locali).
Aggiornamento 4/2/2021
Sta emergendo l'importanza del microbiota intestinale anche nell'anoressia nervosa. Il microbiota influenza, grazie ai suoi effetti neuroendocrini, sia l'appetito che la spesa energetica, e la sua correzione può essere uno degli aspetti da tenere in considerazione
Aggiornamento 18/3/2021
Scoperto un altro collegamento tra sistema immunitario e dieta. L'assorbimento dei nutrienti può essere regolato dalle cellule immunitarie (linfociti), producendo citochine che collegano la regolazione dell'assorbimento dei nutrienti con la regolazione della barriera intestinale. In questo modo la quantità di nutrienti digeriti e assorbiti può cambiare in base a stimoli ambientali (ad esempio infezioni).
"La scoperta che gli stessi meccanismi possono regolare entrambe queste funzioni cruciali nell'intestino tenue può aiutare a spiegare come questo tessuto regola l'equilibrio tra difesa e assorbimento di nutrienti di fronte a continui cambiamenti ambientali".
Aggiornamento 26/3/2021
Le (molte) cause della celiachia rimangono incerte, ma è probabile un coinvolgimento del microbiota alterato. Le infezioni virali, batteriche e fungine possono contribuire alla manifestazione della malattia latente. come l'alterazione della permeabilità intestinale e la mancanza di specie probiotiche.
La disbiosi può anche contribuire al mantenimento dei sintomi della celiachia anche in caso di dieta senza glutine, e il probiotico B. infantis può alleviarli.
Aggiornamento 31/3/2021
Le persone con tiroidite di Hashimoto hanno alti livelli di zonulina e alterato microbiota (riduzione dei bifidi, aumento dei patogeni), suggerendo un ruolo dell'intestino (permeabilità intestinale e mimetismo molecolare) nella genesi e progressione della malattia.
"La leaky gut induce il rilascio di citochine infiammatorie che a loro volta favoriscono una maggiore permeabilità, un circolo vizioso che favorisce l'ingresso di antigeni derivati dalla dieta e dai microbi intestinali, innescando l'attivazione dell'immunità innata e adattativa nella mucosa intestinale. I principali fattori coinvolti nel rilascio di zonulina sono la proliferazione batterica (SIBO) e il glutine e la maggiore permeabilità intestinale può indurre una rottura della tolleranza, quindi le cellule immunitarie attivate possono rimanere nella mucosa intestinale o migrare verso organi distanti, partecipando a malattie infiammatorie croniche e autoimmuni".
Aggiornamento 8/4/2021
Il lievito madre naturale è stato il principale agente lievitante per la produzione del pane fino alla fine del XIX secolo. L'introduzione del lievito di birra nel 1871 ha portato a una graduale sostituzione della fermentazione del lievito naturale, perché permette un processo di impasto più semplice e di breve durata. L'impiego del lievito naturale nella produzione del pane è nuovamente aumentato nell'ultimo decennio, grazie alle superiori proprietà organolettiche del pane a lievitazione naturale; è noto che il pane con lievito madre ha un contenuto inferiore di FODMAP, che vengono degradati durante la fermentazione del lievito naturale, e questo permette di avere una migliore digeribilità. In questo studio si è inoltre dimostrata una riduzione dell'ATI, inibitori dell'alfa-amilasi tripsina, un composto infiammatorio presente nel grano, risultando quindi più digeribile per persone che hanno sensibilità al grano di tipo non celiaco e intestino irritabile.
Aggiornamento 12/4/2021
Batteri e frammenti batterici che entrano nell'intestino grazie alla permeabilità intestinale alterata raggiungono il sangue e gli organi, influenzandone la funzione. Nel tessuto adiposo vengono influenzate infiammazione e lipolisi, nel pancreas e nel fegato la produzione di ormoni, nel tessuto muscolare il consumo di energia e l'uso dei substrati.
"In conclusione, sembra inevitabile che i nostri batteri contribuiscano anche alla modulazione del loro ambiente metabolico plasmando le risposte del corpo ai nutrienti e contribuendo in ultima analisi alla malattia, come è stato dimostrato per il microbiota intestinale negli ultimi anni. Considerando l'attuale rilevanza della ricerca sul microbioma nella comprensione della salute e della nutrizione e le vie promettenti per la terapia e la prevenzione, sarà inevitabile rivisitare molte delle nozioni qui introdotte per consentire approcci meccanicistici robusti e affidabili".
Aggiornamento 23/4/2021
Qualche anno fa i nutrizionisti che parlavano di permeabilità intestinale venivano guardati alla stregua degli aruspici, mentre oggi viene menzionata come concausa della steatosi epatica (fegato grasso), assieme a microbiota alterato, fruttosio industriale, alcol, scarso accesso al cibo salutare (altro termine ritenuto sbagliato, con la solita lungimiranza...) e scarsa attività fisica.
Aggiornamento 4/5/2021
Almeno la metà delle persone con morbo di Parkinson (PD) è positivo al test per la SIBO, con conseguenti problemi intestinali e riduzione dell'assorbimento dei lipidi e delle vitamine liposolubili (vitamina D), ma la condizione può essere anche alla base della malattia.
"La SIBO può innescare una risposta infiammatoria nella mucosa intestinale e aumentare la permeabilità intestinale. L'aumento della permeabilità intestinale porta all'esposizione del sistema immunitario della mucosa a prodotti batterici, come le endotossine, aumentando così l'espressione di alfa-sinucleina. L'alfa-sinucleina può distruggere l'integrità della barriera emato-encefalica e promuovere la neuroinfiammazione e lesioni nella substantia nigra pars compacta. I batteri intestinali aumentano anche l'effetto infiammatorio dell'alfa-sinucleina avviando una risposta immunitaria naturale, causando il ripiegamento errato dell'alfa-sinucleina, che si traduce in effetti neurotossici e apoptosi (morte cellulare) dei neuroni dopaminergici. Questi eventi alla fine portano al verificarsi della PD. La malattia di Parkinson può influenzare il sistema nervoso autonomo e la sua disfunzione può portare a problemi gastrointestinali. Spesso i sintomi gastrointestinali comuni precedono i sintomi motori. Inoltre, molti farmaci usati per trattare la discinesia possono causare disfunzioni gastrointestinali, portando ulteriormente alla SIBO. La SIBO può causare fluttuazioni nel successivo assorbimento di quei farmaci, che influiscono sul trattamento del PD. Secondo i meccanismi di cui sopra, gli studi hanno dimostrato che il trapianto di microbiota fecale e i probiotici possono rappresentare terapie adiuvanti per il PD".
Aggiornamento 8/5/2021
I bambini che usavano il ciuccio sterilizzato con agenti chimici avevano a un anno un rischio di allergie alimentari 5 volte più alto, rispetto al ciuccio lavato con acqua, dalla bocca dei genitori o non lavato. Che legame causale esiste?
"I risultati hanno LEGAMI causali. L'entità della potenziale associazione è elevata. Le tendenze dose-risposta sono evidenti per quanto riguarda l'aumento dell'uso quotidiano in ore e l'aumento della durata dell'uso nei primi 6 mesi. Esistono anche prove biologiche plausibili che il microbiota orale e intestinale giochi un ruolo nello sviluppo precoce del sistema immunitario e nella suscettibilità all'allergia alimentare, in particolare a 6 mesi. Il microbioma intestinale di un neonato matura durante il primo anno di vita, con cambiamenti critici che si verificano quando i bambini vengono svezzati su cibi solidi intorno ai 6 mesi. Alcune specie microbiche promuovono o proteggono dagli ambienti infiammatori attraverso lo sviluppo della risposta TH2 che produce IgE o cellule T regolatorie, favorendo una risposta cellulare che sopprime la produzione di IgE e questo equilibrio modella il sistema immunitario della mucosa".
I prodotti per sterilizzare potrebbero essere, in alternativa, loro stessi induttori di allergia
Aggiornamento 30/5/2021
Un prebiotico, che per il nostro nuovo stile di vita non è più presente nella nostra alimentazione da alcuni decenni, riduce il reflusso gastroesofageo (GERD). Il maltosil-isomalto-oligosaccaride (per gli amici MIMO, ISOT-101) è prodotto dalla fermentazione batterica di alcuni carboidrati.
"Era "probabilmente un alimento base della dieta batterica che era presente nella dieta umana negli ultimi 10.000 anni", ha detto Selling, autore dello studio e professore associato di medicina e gastroenterologia presso la Stanford Medical School, a Stanford, in California.
Il prebiotico, tuttavia, "è assente nella nostra dieta da circa 50 a 100 anni, a causa dei cambiamenti nell'agricoltura, nella produzione alimentare, nella conservazione degli alimenti e nelle preferenze alimentari", ha aggiunto".
L'uso di antiacidi non sempre è efficace (40% delle volte) e il loro uso a lungo termine pone rischi per la salute.
"Il prebiotico potrebbe funzionare perché il microbiota esofageo distale nelle persone con GERD "differisce notevolmente" da quello delle persone sane, ha detto Selling. Il prebiotico potrebbe aiutare a ridurre un aumento anormale dei batteri gram-negativi in questi pazienti, per esempio. Questi ceppi batterici esprimono lipopolisaccaridi (LPS) sulle loro membrane cellulari esterne, che, a loro volta, alterano la segnalazione delle citochine. Questo meccanismo potrebbe portare allo stato iperinfiammatorio associato al GERD.
Selling e colleghi hanno ipotizzato che questo trattamento potrebbe aiutare a risolvere i sintomi della GERD in due modi. Il prebiotico potrebbe alimentare selettivamente i batteri gram-positivi benefici nell'esofago distale, contribuendo così a ripristinare un sano equilibrio dei batteri. ISOT-101 potrebbe anche favorire la produzione di batteriocine che aiutano a uccidere i batteri gram-negativi dannosi e a controllare l'infiammazione".
La risposta al trattamento è stata buona e senza effetti collaterali, a parte 2 persone che hanno avuto nausea, e il 66% delle persone è stata classificata come molto responsiva. La maggior parte ha avuto miglioramenti della qualità della vita e del sonno.
La disbiosi è probabilmente una causa di GERD in molte persone ed è legata anche al tumore gastrico.
Aggiornamento 24/6/2021
Come spiega un articolo dell'American Journal of Gastroenterology, l'approccio "cibo come medicina" può funzionare molto bene in caso di problemi intestinali come reflusso, dispepsia funzionale e gonfiore.
Nel reflusso, il consumo di cioccolato, alcolici, pasti ricchi di grassi, spezie, menta, pomodoro, e in alcuni casi cibi ricchi di fibre, possono favorire la manifestazione.
Per il gonfiore si suggerisce una dieta FODMAP, in cui si evitano alimenti che fermentano, ma va fatta sotto supervisione di un professionista.
Nella dispepsia funzionale, che provoca sazietà precoce, è meglio individuare le sensibilità alimentari personali, anche se grano e alimenti grassi sembrano i maggiori responsabili
Aggiornamento 5/7/2021
Alcune prove portano a pensare che i dolori della sindrome dell'intestino irritabile (IBS) siano dovuti (anche) a reazioni allergiche, che perdurano anche senza esposizione successiva, e sono facilitate da infezioni batteriche che alterano le proprietà della mucosa intestinale. L'istamina agisce localmente per cui non vi è una reazione sistemica classica ma limitata all'intestino. Questo spiegherebbe perché alcune diete di esclusione portano a miglioramenti, e perché la FODMAP non sempre funziona.
"Un'infezione batterica gastrointestinale può rompere la tolleranza orale a un antigene alimentare e provocare una risposta immunitaria adattativa verso quell'antigene, che a sua volta può portare a un aumento della permeabilità intestinale e a una segnalazione anormale del dolore quando si verifica la riesposizione all'antigene. L'esposizione a questi mediatori rende i nervi afferenti ipersensibili e l'ipersensibilità può persistere anche in assenza dell'antigene alimentare scatenante .Esiste uno spettro di risposte allergiche indotte dal cibo, con anafilassi sistemica IgE-mediata da un lato e risposte allergiche specifiche del tessuto gastrointestinale dall'altro. Nel mezzo ci sono malattie del tratto gastrointestinale con risposte allergiche locali indotte dal cibo, come le risposte mastocitarie specifiche del colon descritte da Aguilera-Lizarraga et al. e le risposte eosinofile specifiche dell'esofago nell'esofagite eosinofila. Sebbene molto ancora sia da chiarire, dati recenti supportano l'ipotesi che i disturbi gastrointestinali comuni, come l'IBS e il dolore addominale funzionale, possano invece essere disturbi allergici indotti dal cibo".
Aggiornamento 11/7/2021
L'alimentazione è sicuramente legata a intestino irritabile e altri problemi intestinali, come la dispepsia funzionale, ma è molto difficile risalire alle cause e dimostrarne un legame.
Normalmente i disagi intestinali si riducono facendo ricorso alla dieta FODMAP, che riduce gli zuccheri fermentabili dando così sollievo. Ma esistono diverse cause di dispepsia funzionale legate al cibo. Una può essere la SIBO (eccesso di batteri nella prima parte di intestino) o l'esofagite eosinofila, malattia a base allergica in cui si possono avere IGG elevate. In altri casi può essere il grano o alcune sue componenti, fibre o proteine come glutine e ATI, che possono indurre anche una risposta infiammatoria e immunitaria.
Le proteine del latte, come la caseina A1, possono ugualmente dare problemi, e bisogna distinguere dalla comune intolleranza al lattosio.
Anche la permeabilità intestinale è stata messa in relazione, con l'ingresso nel sangue di proteine allergizzanti o batteri.
Alcune molecole naturali, come salicilati, amine (istamina), glutammato e lectine sono state messe in relazione coi problemi digestivi. Per gli ultimi 2 mancano prove consistenti, ma molti professionisti lavorano anche considerando questi nutrienti. Tra gli additivi invece, la transglutaminasi batterica (pane e altri prodotti industriali), alcuni coloranti e i dolcificanti sono legati a possibili problemi.
L'alterazione del microbiota è un'altra possibile causa e l'uso dei probiotici può aiutare, in particolare Lactobacillus gasseri OLL2716 .
Aggiornamento 24/7/2021
Le divere specie di Candida possono colonizzare l'intestino senza creare problemi, ma quando il sistema immunitario non la tiene più sotto controllo può favorire malattie come le IBD (Crohn e colite ulcerosa). La candida passa alla sua forma di ifa, produce le adesine (proteine che si legano alla superficie intestinale infiammandola) e i biofilm, stimola l'immunità e può espandersi anche oltre l'intestino.
La produzione di anticorpi antiASCA è rivolta sia alla parete della Candida che, in misura inferiore, a quella del S. cerevisiae (lievito di birra).
"Il sistema immunitario dovrebbe mantenere la Candida alla sua forma meno patogena", afferma Kyla Ost, Ph.D., ricercatrice post-dottorato nel laboratorio di Round e autrice principale dello studio. "Questo ci sta dimostrando che la comunicazione tra ospite e microbo può essere amichevole, anziché antagonistica, al fine di beneficiare entrambi".
Aggiornamento 2/8/2021
Qualche mese fa discussi con un medico che si vantava di fare ricerca sulla celiachia, perché secondo lui non c'era prova che il microbiota contasse sulla manifestazione della malattia, e le variazioni del microbiota erano conseguenti alla malattia e non causa. Probabilmente pensava alla celiachia come una punizione divina, e ignorava tutte le prove preliminari già presenti.
Finalmente un gruppo di ricercatori da diversi centri nel mondo ha fatto una "fotografia" del microbiota prima e dopo, mettendo in evidenza che i cambiamenti intervengono già mesi prima e dando la prova a chi non vede oltre il proprio naso (fermo restando che si tratta di patologie multifattoriali).
In particolare si rileva una ridotta abbondanza di alcune specie, tra cui il semplice S. thermophilus presente nello yogurt, associate con un effetto antinfiammatorio e produzione di butirrato. Nei controlli sani si contano anche più bifidobatteri. Invece Porphyromonas, associato con infiammazione e permeabilità intestinale, risulta aumentato (così come in altre malattie autoimmuni.
"L'esordio è caratterizzato da maggiore abbondanza di specie proinfiammatorie e diminuita abbondanza di specie protettive e antinfiammatorie in vari momenti precedenti l'insorgenza della malattia. Questi cambiamenti del microbioma, insieme ad alcuni metaboliti, possono rappresentare potenziali biomarcatori dello sviluppo della CD, che possono essere ulteriormente esaminati per individuare come intervenire sul microbiota e sul metaboloma intestinale per ripristinare la tolleranza al glutine e prevenire l'autoimmunità".
Aggiornamento 5/9/2021